Φυσικές Ιδιότητες
• Τα κατώτερα μέλη της σειράς των κορεσμένων μονοσθενών αλκοολών είναι υγρά, άχρωμα και ευδιάλυτα στο νερό. Τα μέσα μέλη είναι υγρά, ελαιώδη, με σχετικά δυσάρεστη οσμή και διαλύονται πολύ λίγο στο νερό. Τα ανώτερα μέλη είναι στερεά, άοσμα και πρακτικά αδιάλυτα στο νερό.
• Η αιθανόλη είναι υγρό άχρωμο, με ευχάριστη δηκτική γεύση και σχετικά ευχάριστη οσμή. Η αιθανόλη αναμιγνύεται με το νερό σε κάθε αναλογία και κατά την ανάμειξη παρατηρείται ελάττωση όγκου, ενώ εκλύεται θερμότητα.
Χημικές Ιδιότητες 
α. Καύση
Κατά την πλήρη καύση της αιθανόλης, δημιουργείται χαρακτηριστική γαλάζια φλόγα και ελευθερώνεται ικανό ποσό θερμότητας, ώστε να μπορεί να χρησιμοποιηθεί ως καύσιμο.
CH3CH2OH + 3O2 → 2CO2 + 3H2O
H γενική αντίδραση πλήρους καύσης των κορεσμένων μονοσθενών αλκοολών είναι: CvH2v+1OH + 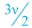 O2 → vCO2 + (v+1)H2O O2 → vCO2 + (v+1)H2O
β. Εστεροποίηση
Οι αλκοόλες δε δημιουργούν ιοντικά διαλύματα και επομένως δε θεωρούνται βάσεις. Οι αλκοόλες όμως αντιδρούν με οξέα και, ενώ η αντίδραση επιφανειακά μοιάζει με την εξουδετέρωση, ουσιαστικά είναι τελείως διαφορετική απ' αυτή και ονομάζεται εστεροποίηση.
π.χ. CH3COOH + CH3CH2OH  CH3COOCH2CH3 + H2O CH3COOCH2CH3 + H2O
αιθανικός αιθυλεστέρας
Γενικά η εστεροποίηση μεταξύ κορεσμένου μονοκαρβοξυλικού οξέος και κορεσμένης μονοσθενούς αλκοόλης δίνεται από τη χημική εξίσωση:
RCOOH + R'OH  RCOOR' + H2O RCOOR' + H2O
γ. Οξείδωση
Οι πρωτοταγείς αλκοόλες οξειδώνονται σε αλδεΰδες και οι αλδεΰδες σε οξέα: RCH2OH 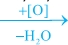 RCHO RCHO  RCOOH RCOOH
π.χ. CH3CH2OH 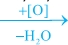 CH3CHO CH3CHO  CH3COOH CH3COOH
αιθανάλη αιθανικό (οξικό) οξύ |