Το ενδιάμεσο προϊόν (βινυλοχλωρίδιο) μπορεί να απομονωθεί και να χρησιμοποιηθεί για την παρασκευή του πολυμερούς PVC.
• Προσθήκη HCN
HC≡CH + HCN → CH2=CH-CN
Ο πολυμερισμός του ακρυλονιτριλίου δίνει προϊόν που χρησιμοποιείται ως τεχνητή υφάνσιμη ύλη (Orlon).
• Προσθήκη Η2Ο (ενυδάτωση αλκινίων)
HC≡CH + HOH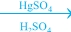 [CH2=CHOH] → CH3CHO [CH2=CHOH] → CH3CHO
ασταθής βινυλική αλκοόλη ακεταλδεύδη
Η βινυλική αλκοόλη που σχηματίζεται αρχικά είναι ασταθής, επειδή στο ίδιο άτομο C υπάρχει και διπλός δεσμός και -ΟΗ ομάδα (ενόλη), και μετατρέπεται γρήγορα σε καρβονυλική ένωση.
β. Καύση 
Η τέλεια καύση του HC≡CH δημιουργεί γαλάζια φλόγα υψηλής θερμοκρασίας (3000 ºC), η οποία ονομάζεται οξυακετυλενική φλόγα και χρησιμοποιείται για την κόλληση και κόψιμο των μετάλλων.
HC≡CH +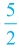 O2 → 2CO2 + H2O O2 → 2CO2 + H2O
γ. Πολυμερισμός
Το HC≡CH μπορεί να πολυμεριστεί σε κατάλληλες συνθήκες σε βενζόλιο (τριμερισμός) ή σε βινυλοακετυλένιο (διμερισμός).
3HC≡CH → C6H6
HC≡CH + HC≡CH CH2=CH-C≡CH CH2=CH-C≡CH
βινυλοακετυλένιο
δ. Αντιδράσεις όξινου υδρογόνου
Τα υδρογόνα του HC≡CH, και γενικότερα τα υδρογόνα που είναι συνδεδεμένα με τον C του τριπλού δεσμού, είναι ευκίνητα (όξινα Η) και εύκολα μπορούν να αντικατασταθούν από άτομα μετάλλων. Τα προϊόντα αυτής της αντικατάστασης ονομάζονται ακετυλενίδια. Απ' αυτά σημαντικότερο είναι το ανθρακασβέστιο (CaC2). Άλλα χαρακτηριστικά παραδείγματα ακετυλενιδίων είναι αυτά του Na ή Κ
HC≡CH + Na → HC≡CNa + 1/2H2
μονονάτριο ακετυλενίδιο
HC≡CH + Na → NaC≡CNa + 1/2H2
δινάτριο ακετυλενίδιο |