Όπου, X-Ψ μπορεί να είναι Η-H, Br-Br, H-Cl, H-OH.
• με υδρογόνο
Η αντίδραση αυτή γίνεται παρουσία καταλύτη, συνήθως Pt και Pd, και ονομάζεται υδρογόνωση.
CH2=CH2 + H2  CH3-CH3 CH3-CH3
και γενικά CvH2v + H2  CvH2v+2 CvH2v+2
• με αλογόνο
π.χ. CH2=CH2 + Br2 → 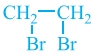
και γενικά CvH2v + Br2 → CvH2vBr2
Αν προσθέσουμε αλκένιο σε διάλυμα Br2 σε τετραχλωράνθρακα, τότε το αλκένιο αντιδρά με το Br2 και το διάλυμα του Br2, από κόκκινο που είναι, αποχρωματίζεται. Την αντίδραση αυτή δεν τη δίνουν τα αλκάνια. Ανάλογες αντιδράσεις προσθήκης με Br2 δίνουν και άλλοι ακόρεστοι υδρογονάνθρακες. Γενικότερα, η προσθήκη Br2 αποτελεί ένα απλό εργαστηριακό έλεγχο της ακορεστότητας, καθώς η άμεση εξαφάνιση του κόκκινης χροιάς του Br2 σημαίνει ότι η ένωση είναι ακόρεστη.
•με υδραλογόνο
π.χ. CH2=CH2 + HCl → CH3CH2Cl
γενικά, CvH2v + HCl → CvH2v+1Cl
Αν αντιδράσει HCl με προπένιο CH3CH = CH2 είναι δυνατόν να σχηματιστούν δύο προϊόντα:
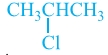 και CH3CH2CH2Cl. Το κύριο προϊόν της παραπάνω αντίδρασης μεταξύ του προπενίου και υδροχλωρίου προβλέπεται ως εξής: |