(Παράδειγμα 1.4)
H στοιχειακή ανάλυση έδειξε, ότι 0,46 g δείγματος οργανικής ένωσης αποτελείται από C, H, και O και ότι κατά την καύση της ίδιας ποσότητας παράγονται 0,88 g CO2 και 0,54 g H2O. H ένωση έχει Mr =46. Ποιος είναι ο μοριακός τύπος της ένωσης και ποιοι είναι οι δυνατοί συντακτικοί τύποι αυτής;
ΛΥΣΗ
Στην άσκηση αυτή ανακεφαλαιώνουμε ότι περίπου μάθαμε στο κεφάλαιο αυτό.
α. Από τη στοιχειακή ανάλυση βρίσκουμε τις ποσότητες άνθρακα και υδρογόνου που περιέχονται στα 0,46g της ένωσης:
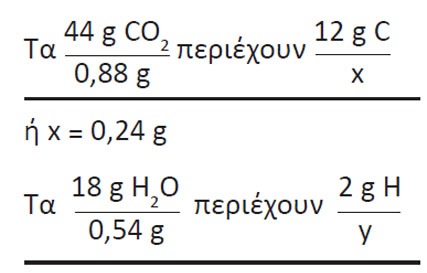
ή y = 0,06 g.
Αθροίζουμε τις ποσότητες C και H : 0,24 g + 0,06 g = 0,3 g.
H ένωση ζυγίζει 0,46 g. Επομένως 0,46 g - 0,3 g = 0,16 g είναι η ποσότητα του οξυγόνου.
β. Βρίσκουμε τον εμπειρικό τύπο της ένωσης:
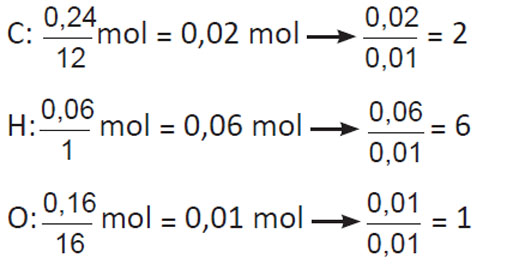
άρα ο εμπειρικός τύπος της ένωσης είναι: (C2H6O)v.
γ. Από τον εμπειρικό τύπο (C2H6O)v με τη βοήθεια του σχετικής μοριακής μάζας υπολογίζουμε ν =1, και ο μοριακός τύπος είναι C2H6O.
δ. H ένωση ανήκει στο γενικό τύπο CvH2v+2Ο. Είναι αλκοόλη ή αιθέρας. Οι δυνατοί συντακτικοί τύποι είναι: CH3CH2OH αιθανόλη ή CH3OCH3 διμεθυλαιθέρας. Av γνωρίζαμε τις ιδιότητες αυτών των ουσιών, θα μπορούσαμε να διακρίνουμε αν η άγνωστη ένωση είναι αλκοόλη ή αιθέρας.
Εφαρμογή
H στοιχειακή ανάλυση έδειξε ότι 0,58 g οργανικής ένωσης αποτελούνται από C, H και O και ότι κατά την καύση της ίδιας ποσότητας οργανικής ένωσης παράγονται 1,32 g CO2 και 0,54 g H2O. H ένωση έχει σχετική μοριακή μάζα 58. Ποιος είναι ο μοριακός τύπος της ένωσης και ποιοι είναι οι δυνατοί συντακτικοί τύποι της; |