O διπλός δεσμός είναι στη θέση: 1
Δηλαδή, η ονομασία της ένωσης είναι: 1-βουτένιο.
- H αρίθμηση της ανθρακικής αλυσίδας αρχίζει από την άκρη που είναι πιο κοντά στο διπλό δεσμό ή γενικά στον πολλαπλό δεσμό.
γ. 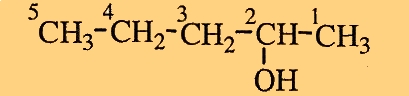
Έχει 5 άτομα C: πεντ-
Είναι κορεσμένη: -αν-
Είναι αλκοόλη: -ολη.
H χαρακτηριστική ομάδα -OH βρίσκεται στη θέση 2.
Δηλαδή η ονομασία της ένωσης είναι: 2-πεντανόλη.
- H αρίθμηση της ανθρακικής αλυσίδας αρχίζει από την άκρη που είναι πιο κοντά στον άνθρακα, που περιέχει τη χαρακτηριστική ομάδα.
δ.
CH3CH2CHCHΟ
Έχει 3 άτομα C: προπ-
Είναι κορεσμένη: -αν-
Είναι αλδεΰδη: -αλη.
Άρα η ονομασία της ένωσης είναι: προπανάλη.
Εδώ να παρατηρήσουμε ότι, αν η χαρακτηριστική ομάδα (XO) είναι μονοσθενής και έχει άνθρακα, όπως η αλδεΰδομάδα -CHO ή το καρβοξύλιο -COOH, τότε η αρίθμηση της ευθύγραμμης αλυσίδας αρχίζει πάντα από τον άνθρακα της χαρακτηριστικής αυτής ομάδας (θέση 1). Γι' αυτό δεν χρειάζεται στην περίπτωση αυτή να καθορίζεται η θέση της XO.
ε. 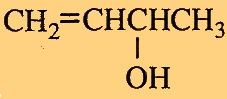
H ένωση ονομάζεται 3-βουτεν-2-όλη.
H αρίθμηση αρχίζει από το άκρο της αλυσίδας που είναι πιο κοντά στη χαρακτηριστική ομάδα και η θέση της ομάδας σημειώνεται πριν από το τρίτο συνθετικό της ονομασίας της ένωσης.
στ.
CH≡CCH2CΟOH
H ένωση ονομάζεται 3-βουτινικό οξύ.
Δε χρειάζεται να καθοριστεί η θέση της χαρακτηριστικής ομάδας -COOH, γιατί όπως έχουμε παρατηρήσει, ο άνθρακας του καρβοξυλίου είναι πάντοτε στη θέση 1. |