4.3 Σταθερά χημικής ισορροπίας Κc - ΚpΓενικά Δύο βασικά ερωτήματα που αφορούν τη χημική αντίδραση είναι: Σταθερά χημικής ισορροπίας - Κc Για μια αμφίδρομη χημική αντίδραση που περιγράφεται από τη χημική εξίσωση: αΑ(g) + βΒ(g) ⇌ γΓ(g) + δΔ(g) αποδεικνύεται ότι στην κατάσταση χημικής ισορροπίας η παράσταση 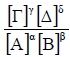 έχει μια σταθερή τιμή που συμβολίζεται με Κc. Η σταθερά αυτή ονομάζεται σταθερά χημικής ισορροπίας και μεταβάλλεται μόνο με τη θερμοκρασία. Η παραπάνω σχέση μεταξύ των συγκεντρώσεων των αντιδρώντων και προϊόντων εκφράζει το νόμο χημικής ισορροπίας.  |
• Η συγκέντρωση του στερεού παραλείπεται από την έκφραση της Κc, καθώς αυτή είναι ανεξάρτητη από την ποσότητά του. Δηλαδή για την ισορροπία: |
Είναι προφανές ότι, όσο μεγαλύτερη είναι η τιμή της Κc τόσο μεγαλύτερο ποσοστό των αντιδρώντων μετατρέπεται σε προϊόντα, δηλαδή τόσο περισσότερο η χημική ισορροπία είναι μετατοπισμένη προς τα δεξιά και όσο μικρότερη είναι η τιμή της Κc τόσο περισσότερο η χημική ισορροπία είναι μετατοπισμένη προς τα αριστερά. Κινητική απόδειξη του νόμου χημικής ισορροπίας Έστω η αμφίδρομη αντίδραση:2A(g) + B(g) ⇌ A2B(g)
η οποία λαμβάνει χώρα σε ένα στάδιο και προς τις δύο κατευθύνσεις, είναι δηλαδή απλή αντίδραση και προς τις δύο κατευθύνσεις. Με βάση το νόμο της ταχύτητας, η ταχύτητα της αντίδρασης προς τα δεξιά είναι: υ1 = k1[A]2[B], και αντίστοιχα προς τα αριστερά είναι: υ2 = k2[A2B]. Στην ισορροπία όμως έχουμε: υ1 = υ2 οπότε, k1[A]2[B] = k2[A2B] ή 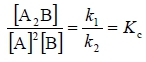  Σταθερά χημικής ισορροπίας – Κp Αν στο σύστημα ισορροπίας συμμετέχουν αέρια, τότε ο νόμος χημικής ισορροπίας μπορεί να εκφραστεί σε συνάρτηση με τις μερικές πιέσεις των αερίων. Η αντίστοιχη σταθερά συμβολίζεται Κp και εξαρτάται μόνο από τη θερμοκρασία. Δηλαδή για τη χημική εξίσωση: |
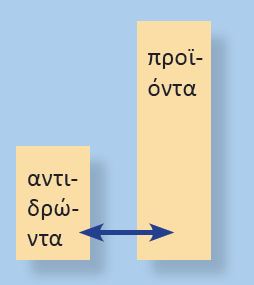 Αν η τιμή της σταθεράς χημικής ισορροπίας έχει μεγάλη τιμή, τότε η απόδόση της αντίδρασης είναι μεγάλη.
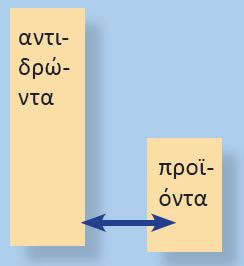 Αν η τιμή της σταθεράς χημικής ισορροπίας έχει μικρή τιμή ,τότε η απόδόση της αντίδρασης είναι μικρή. |
N2(g) + 3H2(g) ⇌ 2NH3(g)
έχουμε: 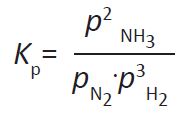 Σχέση που συνδέει την Kp με την Kc Δίνεται η χημική εξίσωση: α Α(g) + β B(g) ⇌ γ Γ(g) + δ Δ(g)
H Kp δίνεται από τη σχέση:
δηλαδή,
Kp = Kc(RT)Δn
όπου, Δn = γ+δ – (α+β), Αν Δn = 0, τότε Kp = Kc Στην περίπτωση αυτή η Kc και η Kp είναι Προς ποια κατεύθυνση κινείται μια αντίδραση; Έστω η ισορροπία: αΑ(g) + βΒ(g) ⇌ γΓ(g) + δΔ(g) 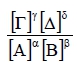 i) Αν Qc = Kc το σύστημα βρίσκεται σε κατάσταση ισορροπίας
ii) Αν Qc < Kc τότε η αντίδραση πηγαίνει προς τα δεξιά, ώστε η τιμή του Qc να μεγαλώσει (μικραίνει ο παρανομαστής του κλάσματος και μεγαλώνει ο αριθμητής). Κατ΄ αυτό τον τρόπο το σύστημα προσεγγίζει τη θέση ισορροπίας, όπου Qc = Kc. iii) Αν Qc > Kc, τότε η αντίδραση οδεύει προς τα αριστερά, ώστε το σύστημα να φτάσει σε ισορροπία. |
• Q = Quotient (λόγος) • Κατ΄ αντιστοιχία το Qp είναι το πηλίκο των μερικών πιέσεων. Η σύγκριση του με το Kp αποτελεί τη βάση για τον καθορισμό της κατεύθυνσης μιας αντίδρασης. |
Παράδειγμα 4.4 Σε δοχείο όγκου 10 L έχουμε σε ισορροπία 40 mol NH3, 20 mol H2 και 60 mol N2. Ποια η τιμή της Kc των παρακάτω εξισώσεων που περιγράφουν το φαινόμενο: ΛΥΣΗ
Για την (1) η τιμή του κλάσματος
Ανάλογα, για τη (2) η τιμή του κλάσματος
Εφαρμογή Σε δοχείο όγκου V έχουμε σε ισορροπία ποσότητες SO2, O2 και SO3. H Kc της αντίδρασης: 2 SO2(g) + O2 (g) ⇌ 2 SO3(g) είναι 4 Lmol-1. |
• Οι μονάδες της Kc εξαρτώνται από τη μορφή της χημικής εξίσωσης. Συνήθως όμως αυτές παραλείπονται.
• Η τιμή της Kc δεν αναφέρεται στη χημική ισορροπία (δηλ. στο χημικό φαινόμενο) που πραγματοποιείται, αλλά στη χημική εξίσωση που περιγράφει την ισορροπία. Γι’ αυτό και η τιμή της αλλάζει, όταν αλλάξει ο τρόπος που γράφεται η χημική εξίσωση, ανεξάρτητα αν περιγράφεται πάντα η ίδια ισορροπία. Η Kc μιας ορισμένης χημικής εξίσωσης (με συγκεκριμένη φορά και συντελεστές) αλλάζει τιμή, μόνο αν αλλάξει η θερμοκρασία. α. 0,25 |
Παράδειγμα 4.5 Σε δοχείο όγκου 1 L υπάρχει ποσότητα στερεού C σε ισορροπία με 4 mol CO2 και 8 mol CO. Ποια είναι η τιμή της Kc της χημικής εξίσωσης ΛΥΣΗ
Εφαρμογή Σε δοχείο όγκου 1 L υπάρχει ποσότητα στερεού C σε ισορροπία με 2 mol CO2 και 6 mol CO σε θερμοκρασία θ1. Ποια είναι η τιμή του Kc για καθεμιά από τις παρακάτω των χημικές εξισώσεις: Παράδειγμα 4.6 Σε δοχείο όγκου 1 L και σε θερμοκρασία 500 °C εισάγονται 3 mol H2 και 3 mol I2. Να υπολογίσετε τον αριθμό mol ΗΙ στη θέση ισορροπίας, καθώς και την απόδοση της αντίδρασης, αν η Kc της χημικής εξίσωσης Η2(g) + I2(g) ⇌ 2HI(g) στους 500 °C ισούται με 49. ΛΥΣΗ
|
α. 18 |
||||||||||||||||||||
Στην κατάσταση χημικής ισορροπίας ισχύει ο τύπος:
λύση, η οποία ικανοποιεί τον περιορισμό που θέσαμε και είναι δεκτή. Εφαρμογή Σε δοχείο όγκου 1 L και σε θερμοκρασία θ1 εισάγονται 4 mol PCl5 που διασπώνται μερικώς, σύμφωνα με τη χημική εξίσωση. Πόσα mol Cl2 θα έχουμε στην ισορροπία αν η Kc της αντίδρασης: Παράδειγμα 4.7 Σε δοχείο όγκου 41 L εισάγονται 2 mol N2O4. Θερμαίνουμε στους 27 °C οπότε το N2O4 διασπάται μερικώς, σύμφωνα με την αντίδραση: ΛΥΣΗ
Στην ισορροπία έχουμε: |
3 mol |
||||||||||||||||
Εφαρμογή Σε κλειστό δοχείο όγκου V = 8,2 L εισάγονται 2 mol PCl5 και θερμαίνουμε στους 227 °C, οπότε ο PCl5 διασπάται μερικώς σύμφωνα με την αντίδραση: Παράδειγμα 4.8 Σε δοχείο όγκου V = 20 L εισάγονται στους 500 °C 4 g Η2, 508 g Ι2 και 1024 g HI. Να διερευνήσετε αν το σύστημα είναι σε ισορροπία. Αν όχι, προς ποια κατεύθυνση οδεύει η αντίδραση και ποιες θα είναι οι ποσότητες των αερίων στη θέση ισορροπίας; Δίνεται ότι, η Kc της παρακάτω αντίδρασης στους 500 °C είναι 9.Η2(g) + Ι2(g) ⇌ 2ΗΙ(g)
ΛΥΣΗ |
p Cl2 =2,5 atm, Κp = 5/6 |
Διαπιστώνουμε ότι Qc > Kc, συνεπώς το σύστημα δεν είναι σε κατάσταση ισορροπίας και μάλιστα η αντίδραση οδεύει προς τα αριστερά μέχρις ότου το κλάσμα πάρει την τιμή Qc' = Kc. Ονομάζουμε x mol την ποσότητα του ΗΙ που αντιδρά και σχηματίζουμε το σχετικό πίνακα.
Στην ισορροπία: Εφαρμογή Σε δοχείο όγκου 10 L, εισάγουμε 0,6 mol N2, 0,4 mol Η2 και 0,4 mol NH3 σε θερμοκρασία 375 °C. Αν η Kc της αντίδρασης: Παράδειγμα 4.9 Σε δοχείο όγκου 1 L που περιέχει σε ισορροπία 0,8 mol SO2, 0,1 mol NO2, 0,6 mol SO3 και 0,4 mol NO προσθέτουμε 0,3 mol NO2. Τι θα συμβεί στην ισορροπία και ποια θα είναι η ποσότητα του ΝΟ2 στην τελική ισορροπία; ΛΥΣΗ |
|||||||||||||||||||||
Από την αρχική ισορροπία υπολογίζουμε την Kc: 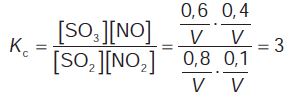 όπου V ο όγκος του δοχείου σε L. Εφαρμογή Σε δοχείο 2 L έχουμε σε ισορροπία 4 mol PCl5, 2 mol PCl3 και 8 mol Cl2. Προσθέτουμε 4 mol PCl5. Ποιες οι ποσότητες όλων των αερίων στη νέα ισορροπία; Παράδειγμα 4.10 Σε δοχείο όγκου 2 L έχουμε σε ισορροπία 8 mol PCl5, 4 mol PCl3 και 8 mol Cl2. Διπλασιάζουμε τον όγκο του δοχείου και διατηρούμε τη θερμοκρασία σταθερή. Πόσα mol Cl2 θα έχουμε στη νέα ισορροπία; ΛΥΣΗ
|
6,94 mol, 3,06 mol, |
||||||||||||||||||||||||||||||||||||||||||||||||||
Από την αρχική ισορροπία υπολογίζουμε την τιμή της Kc: 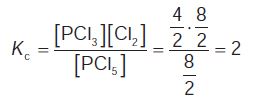 Η θερμοκρασία μένει σταθερή, άρα και η Kc. Στην τελική ισορροπία από την τιμή της Kc υπολογίζουμε: Εφαρμογή Σε ένα δοχείο που έχει όγκο V1 = 3 L βρίσκονται σε ισορροπία 2 mol N2O4 και 1 mol NO2, σύμφωνα με τη χημική εξίσωση: Παράδειγμα 4.11 Σε δοχείο όγκου 10 L εισάγονται 1 mol Η2 και 1 mol I2 στους 450 °C. ΛΥΣΗ
|
1,5 mol N2O4, 2 mol NO2 |
||||||||||||||||||||
Στην κατάσταση χημικής ισορροπίας στους 450 °C: 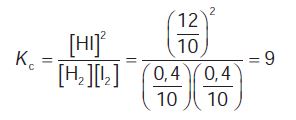 β. Με την αύξηση της θερμοκρασίας η ισορροπία μετατοπίζεται προς τα δεξιά, όπως φαίνεται από την εκφώνηση, και αντιδρούν (0,4–0,2) mol Η2. Μετά από αυτή την παρατήρηση σχηματίζουμε πάλι τον αντίστοιχο πίνακα:
Στην κατάσταση χημικής ισορροπίας στους 600 °C: Εφαρμογή Σε δοχείο όγκου 3 L στους θ °C, ισορροπούν 5 mol Ν2, 4 mol H2 και 12 mol NH3, σύμφωνα με την αντίδραση:
|
|||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||
|
|
|
||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||
|