3
|
ΠΕΡΙΕΧΟΜΕΝΑ
|
||||||||||
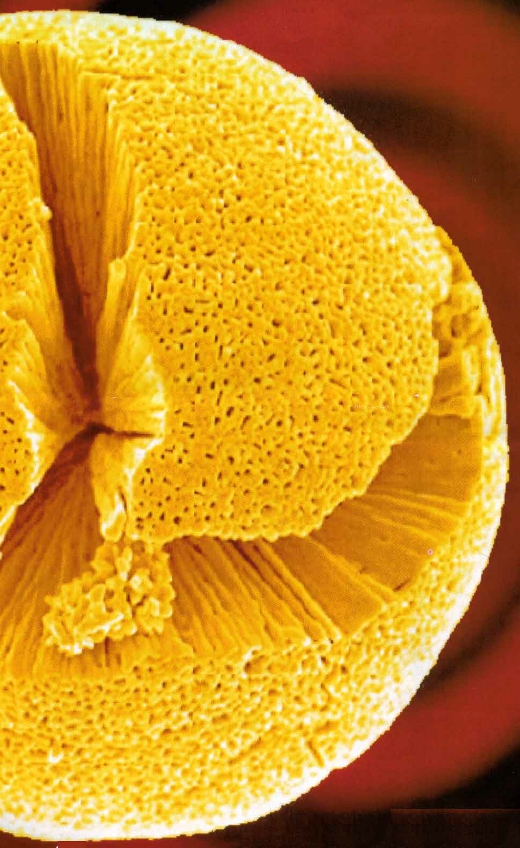 Για να είναι ένας στερεός καταλύτης αποτελεσματικός, θα πρέπει να έχει μεγάλη επιφάνεια. Αυτό μπορούμε να το πετύχουμε παρασκευάζοντας τον καταλύτη υπό μορφή πολύ μικρών κόκκων. Οι σχετικές τεχνικές έχουν φτάσει στα όρια των δυνατοτήτων διαίρεσης της ύλης, στην κρυσταλλική κατάσταση, αφού μειώνονται οι διαστάσεις των κόκκων σε μεγέθη της τάξεως του νανόμετρου(10-9 m). Οι «νανοδομές» αυτές δεν είναι δυνατόν να προκύψουν από λειοτρίβηση. Για παράδειγμα τo διοξείδιο του τιτανίου -TiO2- παρασκευάζεται με εξάτμιση του μεταλλικού τιτανίου-Ti(s)- σε αδρανή ατμόσφαιρα υπό ελαττωμένη πίεση. Οι ατμοί του τιτανίου Ti(g)- συμπυκνώνονται σε επιφάνεια που διατηρείται σε θερμοκρασία υγρού αζώτου και στη συνέχεια οξειδώνονται προς TiO2 . Στον κόσμο των «νανόκοκκων» παρουσιάζονται νέες συναρπαστικές ιδιότητες της ύλης. Μ΄ αυτή την μορφή το TiO2 παρουσιάζει σπουδαία καταλυτική δράση, το οποίο δε συμβαίνει με το TiO2 στην κανονική του μορφή. Στην εικόνα, φαίνεται η μικρογραφία ενός κόκκου τιτανίου, όπως έχει ληφθεί από ένα ηλεκτρονικό μικροσκόπιο. Η μορφολογία του κόκκου είναι σπογγώδης και είναι σύμφωνη με τη «Θεωρία Προσρόφησης» για την ερμηνεία της καταλυτικής δράσης. |
Να παρατηρήσουμε ότι μια χημική εξίσωση, όπως π.χ. 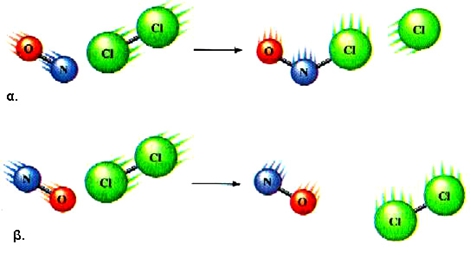 ΣΧΗΜΑ 3.1 Για να γίνει η αντίδραση NO+Cl2 → NOCl + Cl |
 Arrhenius Σουηδός χημικός. Η θεωρία του σχετικά με τη διάσταση των ηλεκτρολυτών ήταν καρπός της διδακτορικής του διατριβής, η οποία σχεδόν απορρίφθηκε από τους εξεταστές του. Αργότερα, η θεωρία αυτή βραβεύτηκε με το Νόμπελ Χημείας το 1903. Σήμερα είναι γνωστός κυρίως από την εξίσωση που φέρει το όνομα του και η οποία συσχετίζει την ταχύτητα μιας αντίδρασης με τη θερμοκρασία.
• Έχει υπολογιστεί, σύμφωνα με την κινητική θεωρία των αερίων, ότι σε αέρια όγκου 1L σε STP συνθήκες γίνονται περίπου 1032 συγκρούσεις μορίων το δευτερόλεπτο. |
Σύμφωνα με μια άλλη θεωρία, τη θεωρία της μεταβατικής κατάστασης, για να πραγματοποιηθεί μια αντίδραση θα πρέπει να σχηματιστεί κατά τη σύγκρουση των αντιδρώντων ένα ενδιάμεσο προϊόν. Το προϊόν αυτό απορροφά την ενέργεια ενεργοποίησης και ονομάζεται ενεργοποιημένο σύμπλοκο. 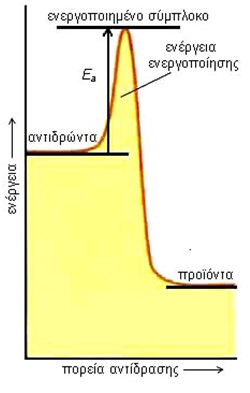 ΣΧΗΜΑ 3.2 Για να πραγματοποιηθεί μια αντίδραση θα πρέπει τα αντιδρώντα μόρια να έχουν μια ελάχιστη τιμή ενέργειας (ενέργεια ενεργοποίησης, Εa). Ταχύτητα αντίδρασης - Ορισμός Ας πάρουμε για παράδειγμα την αντίδραση: |
 Για να γίνει μια χημική αντίδραση Α → Β χρειάζεται ένα ελάχιστο ποσό ενέργειας, που ονομάζεται ενέργεια ενεργοποίησης. |
Σύμφωνα με τη στοιχειομετρία της παραπάνω χημικής εξίσωσης, αν σε χρονικό διάστημα Δt αντιδράσουν χ mol HI σχηματίζονται χ/2 mol H2 και χ/2 mol I2. Έτσι, εύκολα μπορούμε να διαπιστώσουμε ότι: Δηλαδή ο ρυθμός μεταβολής της συγκέντρωσης του ΗΙ είναι διπλάσιος του αντίστοιχου του Η2 και Ι2. Γενικά ορίζεται ταχύτητα υ μιας χημικής αντίδρασης της μορφής 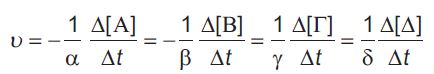 Έτσι, η ταχύτητα της αντίδρασης 2ΗΙ(g) → H2(g) + I2(g) είναι: Να σημειωθεί ότι η ταχύτητα της αντίδρασης δεν είναι σταθερή καθ’ όλη τη διάρκεια της. Στην αρχή (εκτός ελαχίστων εξαιρέσεων) η ταχύτητα είναι η μέγιστη. Ελαττώνεται, όμως, με την πάροδο του χρόνου, καθώς μειώνεται η συγκέντρωσης των αντιδρώντων, ώσπου στο τέλος να μηδενιστεί. Είναι λοιπόν αυτονόητο, ότι οι μετρήσεις μεταβολών συγκεντρώσεων αντιδρώντων ή προϊόντων σε κάποιο χρονικό διάστημα , Δt, αφορούν τον προσδιορισμό της μέσης ταχύτητας της αντίδρασης για το χρονικό αυτό διάστημα. Στιγμιαία ταχύτητα χημικής αντίδρασης, που έχει τη γενική μορφή 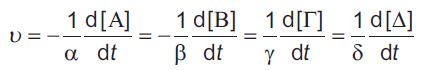 όπου dc είναι μια απειροελάχιστη μεταβολή της συγκέντρωσης c, κατά την απειροελάχιστη μεταβολή dt του χρόνου στη χρονική στιγμή t. |
Διαγραμματική απεικόνιση της πορείας μιας υποθετικής αντίδρασης της μορφής: 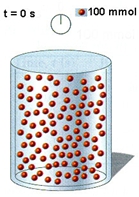 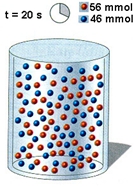 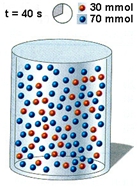 Vδοχ= 1 L 1. Ρυθμός μεταβολής της συγκέντρωσης του Β την περίοδο 0 - 20 s 2. Ρυθμός μεταβολής της συγκέντρωσης του Β την περίοδο 20 - 40 s 3. Ρυθμός μεταβολής της συγκέντρωσης του Β την περίοδο 0 - 40 s |
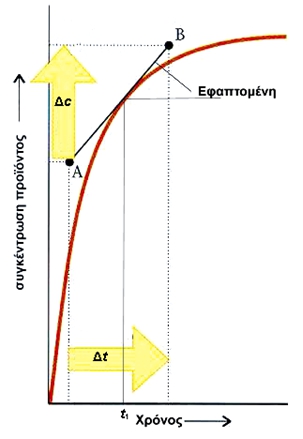 ΣΧΗΜΑ 3.3 Για να υπολογίσουμε τη στιγμιαία ταχύτητα τη χρονική στιγμή t1, φέρνουμε την εφαπτομένη της καμπύλης που αντιστοιχεί στο σημείο t1 και υπολογίζουμε τη κλίση της. Η κλίση της ευθείας αυτής βρίσκεται αν πάρουμε δύο σημεία της Α και Β και υπολογίσουμε το Δc και Δ t. Η στιγμιαία ταχύτητα σχηματισμού προιόντος υ t1 τη χρονική στιγμή t1 δίνεται από τη σχέση: υ t1 = Δc/Δt Παράδειγμα 3.1 Η ταχύτητα σχηματισμού της ΝΗ3 Ν2(g) + 3H2(g) → 2NH3(g) είναι 2,5 mol L-1 h-1. α) Ποιος είναι ο ρυθμός κατανάλωσης του Η2 στο ίδιο χρονικό διάστημα; β) Ποια είναι η ταχύτητα της αντίδρασης; ΛΥΣΗ Εφαρμογή Ο ρυθμός σχηματισμού του HI, Η2 + I2 → 2HI είναι 0,04 mol L-1s-1. |
Πειραματικός προσδιορισμός της ταχύτητας της αντίδρασης: 2H2O2(l) → 2H2O(l) + O2(g)  α. t = 0 s, m = 1246,050 g 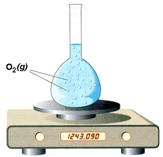 β. t = 60 s, m = 1243,090 g |
Παράδειγμα 3.2 Η συγκέντρωση του αιθυλενίου CH2 = CH2 στην αντίδραση:
α. Να βρεθεί η μέση ταχύτητα της αντίδρασης για τα πρώτα 20 s. ΛΥΣΗ 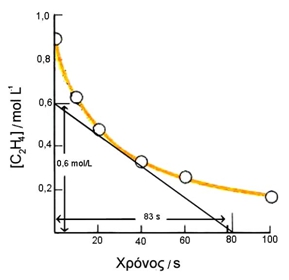 Από την καμπύλη της αντίδρασης υπολογίζουμε την ταχύτητα της αντίδρασης 30s μετά την έναρξη των μετρήσεων Εφαρμογή Η κινητική μελέτη της αντίδρασης 2Α → Β + 3Γ οδήγησε στον παρακάτω πίνακα μετρήσεων:
α. Να βρεθεί η μέση ταχύτητα της αντίδρασης στα πρώτα 2 min. |