1
|
ΠΕΡΙΕΧΟΜΕΝΑ
|
|||||||||
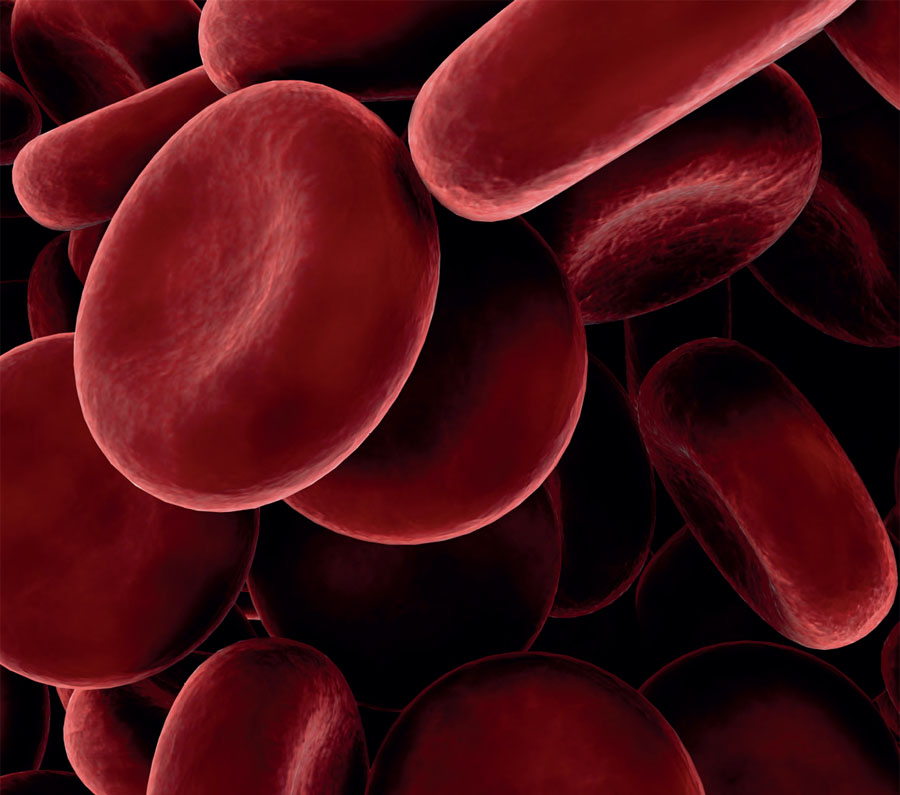
Τα ερυθρά αιμοσφαίρια είναι κύτταρα του αίματος που περιέχουν κόκκινη χρωστική. Η κύρια λειτουργία τους είναι να μεταφέρουν οξυγόνο από τους πνεύμονες σε όλους τους ιστούς του σώματος. Έχουν σχεδόν ομοιόμορφο μέγεθος με διάμετρο περίπου 8μm και σχήμα αμφικοίλων δίσκων, όπως δείχνει η μικρογραφία που έχει δώσει ηλεκτρονικό μικροσκόπιο. Το ερυθρό αιμοσφαίριο περικλείεται απο μια λεπτή μεμβράνη που είναι ημιπερατή. Γι' αυτό αν τα αιμοσφαίρια βρεθούν σε πολύ αραιό διάλυμα (υποτονικό) προσλαμβάνουν νερό, διογκώνονται και αποκτούν σφαιροειδές σχήμα. Αν αυτό συνεχιστεί για πολύ τότε τα αιμοσφαίρια σπάζουν ελευθερώνοντας τα συστατικά τους (αιμόλυση). |
Δεσμοί Van der Waals1. Δυνάμεις διπόλου - διπόλουΣτο κεφάλαιο του μοριακού δεσμού έχει γίνει λόγος για την πολικότητα των μορίων. Έτσι, στο μόριο του HCl το φορτίο του κοινού ζεύγους των ηλεκτρονίων, μέσω του οποίου γίνεται η σύνδεση των δύο ατόμων, είναι μετατοπισμένο προς το ηλεκτραρνητικότερο άτομο του Cl με αποτέλεσμα την εμφάνιση κέντρου αρνητικού φορτίου σ' αυτό (σύμβολο δ-). Η μετατόπιση αυτή δημιουργεί επίσης θετικό φορτίο στο άλλο άκρο του μορίου, που είναι το άτομο του Η (σύμβολο δ+). Το μόριο δηλαδή του HCl είναι πολικό και συμπεριφέρεται ως ηλεκτρικό δίπολο, χαρακτηριστικό μέγεθος του ο ποίου είναι η διπολική ροπή, μ. Όταν δύο πολικά μόρια π.χ. μόρια HCl βρεθούν με κατάλληλο προσανατολισμό, όπως φαίνεται στο παρακάτω σχήμα, έλκονται μεταξύ τους και πλησιάζουν το ένα στο άλλο. Κατ΄ αυτό τον τρόπο αποκτούν μικρότερη ενέργεια, άρα και μεγαλύτερη σταθερότητα. ΣΧΗΜΑ 1.1
Γενικεύοντας, καταλήγουμε στο συμπέρασμα, ότι στα πολικά μόρια οι διαμοριακές ελκτικές δυνάμεις είναι ηλεκτροστατικής φύσης μεταξύ των ετερώνυμα φορτισμένων άκρων, πόλων, των μορίων. Η ισχύς των δεσμών αυτών αυξάνει όσο αυξάνει η διπολική ροπή των μορίων (με την προϋπόθεση τα μόρια να έχουν περίπου την ίδια μάζα και όγκο). Eίναι εύκολο να καταλάβει κανείς, ότι όσο ισχυρότερες είναι αυτές οι δυνάμεις, τόσο «ευκολότερα» υγροποιείται ένα αέριο σώμα, δηλαδή τόσο μεγαλύτερο σημείο βρασμού έχει. Και ανάποδα, όσο μικρότερες είναι οι διαμοριακές δυνάμεις, τόσο «δύσκολα» υγροποιείται ένα αέριο. Αυτό φαίνεται και στον παρακάτω πίνακα:
|
J.D. Van der Waals (1837- 1923). Ολλανδός φυσικός, τιμήθηκε με το βραβείο Νόμπελ Φυσικής το 1910, για τη διατύπωση της καταστατικής εξίσωσης των μη ιδανικών αερίων. H εξίσωση αυτή, γνωστή ως εξίσωση Van der Waals, στηρίζεται στις δυνάμεις που αναπτύσσονται μεταξύ των μορίων (δυνάμεις Van der Waals). • Η διπολική ροπή αποτελεί το μέτρο της πολικότητας του μορίου και είναι διανυσματικό μέγεθος. Το μέτρο του δίνεται από τη σχέση μ = δ . r όπου, δ: το στοιχειώδες φορτίο (δ+ ή δ-) και r : η απόσταση των πόλων Να υπογραμμίσουμε, ότι η διπολική ροπή ενός μορίου εξαρτάται από την πόλωση των δεσμών ( διαφορά ηλεκτραρνητικότητας ανάμεσα στα άτομα του δεσμού) και τη γεωμετρία του μορίου. ‘Ετσι, υπάρχουν μόρια, όπως τουCH4, που ενώ έχουν πολωμένους δεσμούς συνολικά δεν εμφανίζουν διπολική ροπή, λόγω συμμετρίας του μορίου. |
ΣΧΗΜΑ 1.2 Απεικόνιση διαμοριακών δυνάμεων μεταξύ πολικών μορίων. 2. Δυνάμεις διασποράς (London) |
|
Είναι γνωστό ότι και τα μη πολικά μόρια των στοιχείων, όπως π.χ. του Ηe, H2, O2, N2, μπορούν σε πολύ χαμηλές θερμοκρασίες (κοντά στο απόλυτο μηδέν) να συμπυκνωθούν σε υγρά. Άρα μεταξύ των μη πολικών μορίων θα πρέπει επίσης να ασκούνται κάποιες ελκτικές δυνάμεις. Το 1926 ο Γερμανός Fritz London (1900-1954) πρότεινε μία εξήγηση για τις δυνάμεις αυτές. Ας πάρουμε για παράδειγμα τα άτομα He. Η μέση κατανομή των ηλεκτρονίων γύρω από κάθε πυρήνα είναι συμμετρική (σφαιρική). Τα άτομα είναι μη πολωμένα και δεν παρουσιάζουν διπολική ροπή. Η στιγμιαία όμως κατανομή των ηλεκτρονίων δεν παρουσιάζει συνεχώς την ίδια εικόνα, όπως φαίνεται στο σχήμα 1.3. Σε κάποιο κλάσμα του χρόνου και τα δύο ηλεκτρόνια του ατόμου του He είναι προς το ένα άκρο του φορτίζοντάς το, στιγμιαία, αρνητικά. Τότε, το άλλο άκρο φορτίζεται θετικά και έτσι, δημιουργούνται στιγμιαία δίπολα. Μεταξύ των στιγμιαίων αυτών διπόλων αναπτύσσονται ασθενείς ελκτικές δυνάμεις, οι οποίες ονομάζονται δυνάμεις London ή διασποράς (επειδή οι δυνάμεις δεν έχουν μια ορισμένη κατεύθυνση).
ΣΧΗΜΑ 1.3 α. Συμμετρική μέση κατανομή ηλεκτρονίων σε δύο άτομα He. β. Σχηματισμός στιγμιαίων δίπολων. Η ισχύς των δεσμών αυτών εξαρτάται: |
• Μια από τις συνέπειες των διαμοριακών δεσμών : Η υγροποίηση των μη πολικών αερίων π.χ. των ευγενών αερίων. |
ΣΧΗΜΑ 1.5 Σύνδεση μεταξύ των μορίων Η2Ο στον πάγο. Ο δεσμός υδρογόνου δεν υπάρχει μόνο μεταξύ των μορίων του νερού, αλλά εμφανίζεται γενικότερα σε ενώσεις που έχουν τους δεσμούς Ν−Η, Ο−Η, F−Η. Δηλαδή, ο δεσμός υδρογόνου αναπτύσσεται σε ενώσεις, όπου το Η είναι ενωμένο ομοιοπολικά με άτομα ισχυρά ηλεκτραρνητικά και μικρό μέγεθος π.χ. F, O, N. Στις περιπτώσεις αυτές, η ισχυρή έλξη που ασκεί το ηλεκτραρνητικό στοιχείο στο κοινό ζεύγος ηλεκτρονίων αφήνει το άτομο του Η σχεδόν «γυμνό» από ηλεκτρόνια, ως Η δ+ . Υπό την μορφή αυτή το άτομο Η έλκει το αρνητικά φορτισμένο μέρος (F, Ν, Ο) ενός άλλου μορίου. Κατ΄ αυτό τον τρόπο το άτομο Η συνδέεται ταυτόχρονα με δύο πολύ ηλεκτραρνητικά άτομα, πρώτον με ομοιοπολικό δεσμό (στο ίδιο μόριο) και δεύτερον με δεσμό υδρογόνου (στο άλλο μόριο). Ο ΔΕΣΜΟΣ ΥΔΡΟΓΟΝΟΥ ΕΧΕΙ ΤΗ ΜΟΡΦΗ: Ο δεσμός υδρογόνου εμφανίζεται σε πολλά βιολογικά μόρια, όπως π.χ. στις πρωτεΐνες. Η παρουσία του πολλές φορές προκαλεί την εμφάνιση χαρακτηριστικών ιδιοτήτων. Έτσι για παράδειγμα το υδροφθόριο HF εμφανίζει ασθενή όξινο χαρακτήρα, σε αντίθεση με τα υπόλοιπα υδραλογόνα που είναι ισχυρά οξέα Στα μόρια του HF οι γέφυρες υδρογόνου, οι οποίες συμβολίζονται με τρεις στιγμές, αναπτύσσονται μεταξύ ενός ζεύγους ηλεκτρονίων του Fδ- και του Ηδ+ του γειτονικού μορίου, όπως φαίνεται παρακάτω:
|
• Δεσμός ή γέφυρα υδρογόνου : είναι μια ειδική περίπτωση διαμοριακού δεσμού διπόλου-διπόλου, που εμφανίζεται σε ενώσεις με δεσμούς Ν−Η, Ο−Η, F−Η.
Μερικές από τις συνέπειες του δεσμού υδρογόνου:
• Υπό μορφή πάγου τα μόρια του νερού έχουν το μέγιστο αριθμό δεσμών υδρογόνου. Έτσι η πυκνότητα του πάγου είναι μικρότερη του νερού, για αυτό και ο πάγος επιπλέει. Μ΄ αυτό τον τρόπο ο πάγος μονώνει τις παγωμένες θάλασσες και λίμνες και διατηρεί το νερό κάτω από αυτό σε σχετικά υψηλές θερμοκρασίες. Έτσι διατηρείται η ζωή στους πόλους. |
Παρακάτω δίνεται ένας πίνακας με την ισχύ των διαμοριακών δεσμών σε σχέση με τις αντίστοιχες τιμές των χημικών (ενδομοριακών) δεσμών.
Παράδειγμα 1.2 Δίνονται τα υδραλογόνα HF, HCl, HBr, HJ με σημεία βρασμού 290 Κ, 188 Κ, 206 Κ, 238 Κ, αντίστοιχα. Πώς εξηγείτε την τιμή των 290 Κ για το HF; ΑΠΑΝΤΗΣΗ Εφαρμογή Δίνονται οι υδρογονούχες ενώσεις των στοιχείων της έκτης ομάδας του περιοδικού συστήματος Η2Ο, H2S, H2Se, H2Te με σημεία βρασμού 373 Κ, 219 Κ, 232 Κ και 271 Κ αντίστοιχα. Πώς εξηγείτε την τιμή των 373 Κ για το Η2Ο; |
Μεταβολές καταστάσεων της ύλης
|
 Στερεό ιώδιο σε ισορροπία με τους ατμούς του. • Εξαέρωση: η μετάβαση ενός υγρού στην αέρια κατάσταση. Απαιτείται θερμότητα (ενδόθερμο φαινόμενο). Η εξαέρωση μπορεί να γίνει, είτε από την επιφάνεια του υγρού, με εξάτμιση, είτε από όλη τη μάζα του υγρού με βρασμό. • Υγροποίηση ή συμπύκνωση: είναι η μετάβαση από την αέρια στην υγρή κατάσταση. Στην περίπτωση αυτή ελευθερώνεται θερμότητα (εξώθερμο φαινόμενο). • Τήξη: η μετάβαση από τη στερεά στην υγρή κατάσταση. Απαιτείται θερμότητα (ενδόθερμο φαινόμενο). • Πήξη: η μετάβαση από την υγρή στη στερεά κατάσταση. Ελευθερώνεται θερμότητα (εξώθερμο φαινόμενο). • Εξάχνωση: η μετάβαση από τη στερεά στην αέρια κατάσταση. Απαιτείται θερμότητα (ενδόθερμο φαινόμενο). • Κατά τη μετάβαση ενός σώματος από μια φυσική κατάσταση σε μια άλλη η θερμοκρασία του σώματος διατηρείται σταθερή. Π.χ. κατά τη διάρκεια της πήξης του νερού η θερμοκρασία. Δηλαδή διατηρείται στους 0οC(σημείο πήξεως του νερού) |
Υπάρχουν μερικές ουσίες οι οποίες δεν μπορούν να καταταγούν στις τρεις αυτές καταστάσεις ύλης. Το γυαλί π.χ. έχει χαρακτηριστικά της στερεάς αλλά και της υγρής κατάστασης. Επίσης τα τελευταία χρόνια μεγάλη εφαρμογή βρίσκουν και οι υγροί κρύσταλλοι, που επίσης έχουν ιδιότητες μεταξύ κρυσταλλικού και υγρού σώματος. 
ΣΧΗΜΑ 1.8 Βενζόλιο στην υγρή και στερεή μορφή του, αντίστοιχα.
Είναι προφανές ότι τα αέρια έχουν πλουσιότερο εσωτερικό ενεργειακό περιεχόμενο σε σύγκριση με τα υγρά, των οποίων οι δομικές μονάδες συγκρατούνται με ισχυρότερες διαμοριακές δυνάμεις. Κατ’ επέκταση τα υγρά είναι πιο πλούσια σε ενέργεια από τα στερεά. Ιδιότητες υγρών Μετά την εισαγωγή που κάναμε σχετικά με τους διαμοριακούς δεσμούς και τη μεταβολή των φυσικών καταστάσεων της ύλης θα μελετήσουμε μερικές από τις πλέον χαρακτηριστικές ιδιότητες των υγρών. Είναι γνωστό ότι ορισμένα υγρά, όπως το μέλι, το λάδι κ.λπ., είναι παχύρευστα και κυλούν δύσκολα στην επιφάνεια ενός στερεού. Αντίθετα, το νερό, η βενζίνη κυλούν πολύ εύκολα. Η αντίσταση ενός υγρού στη ροή ονομάζεται ιξώδες. Το ιξώδες, μια και έχει να κάνει με την κίνηση μεταξύ μορίων, συσχετίζεται με τους διαμοριακούς δεσμούς. Είναι προφανές, ότι όσο ισχυρότεροι είναι οι διαμοριακοί δεσμοί τόσο μεγαλύτερο είναι το ιξώδες. Γενικά το ιξώδες των υγρών μειώνεται με την αύξηση της θερμοκρασίας. Τα μόρια στο εσωτερικό ενός υγρού δέχονται ελκτικές δυνάμεις από άλλα γειτονικά μόρια από όλες τις διευθύνσεις. Η συνισταμένη των δυνάμεων αυτών είναι μηδέν. Αντίθετα, τα επιφανειακά μόρια δέχονται ελκτικές δυνάμεις μόνο προς το εσωτερικό της μάζας του υγρού, με αποτέλεσμα να μειώνεται η επιφάνεια του υγρού (οι σφαίρες έχουν το μικρότερο δυνατό εμβαδόν επιφάνειας). Εξ αιτίας των δυνάμεων αυτών συσσωρεύονται περισσότερα μόρια στο ίδιο εμβαδόν επιφανείας, με αποτέλεσμα να δημιουργείται ένα είδος «επιδερμίδας» στην επιφάνεια του υγρού. Γι’ αυτό και τα έντομα μπορούν να περπατήσουν στην επιφάνεια ενός υγρού, όπως φαίνεται στο διπλανό σχήμα. |
 Το στερεό διοξείδιο του άνθρακα εξαχνώνεται, πηγαίνει δηλαδή απ΄ ευθείας από τη στερεά στην υγρή κατάσταση. Το άσπρο σύννεφο που δημιουργείται οφείλεται στη συμπύκνωση των υδρατμών και χρησιμοποιείται πολλές φορές σε θεατρικά εφέ.
 Υγρό άζωτο κατά τη διάρκεια εξάτμισής του.
 Οι υγροί κρύσταλλοι βρίσκουν εφαρμογή στην ιατρική και στην τεχνολογία των μικρών φορητών ηλεκτρονικών οργάνων, όπως ρολόγια και υπολογιστικές μηχανές.
|
 ΣΧΗΜΑ 1.10 Το πρώτο δοχείο απεικονίζει το υγρό στην αρχική κατάσταση και το δεύτερο στην κατάσταση ισορροπίας. Η τάση ατμών ενός υγρού αναφέρεται στην κατάσταση ισορροπίας υγρού - ατμού σε μια ορισμένη θερμοκρασία. Η τάση ατμών ενός υγρού εξαρτάται από: Παράδειγμα 1.3 Σε κλειστό δοχείο επικρατεί δυναμική ισορροπία μεταξύ υγρού νερού
και υδρατμών. Τι θα συμβεί αν στην παραπάνω ισορροπία: ΑΠΑΝΤΗΣΗ Εφαρμογή Σε κλειστό δοχείο επικρατεί δυναμική ισορροπία μεταξύ υγρής αιθυλικής αλκοόλης και ατμών της αιθυλικής αλκοόλης. Οι ατμοί της αλκοόλης είναι 0,01 mol στις συγκεκριμένες συνθήκες. Αυξάνουμε τη θερμοκρασία, ενώ ο όγκος του δοχείου παραμένει σταθερός. Η ποσότητα της αλκοόλης θα είναι α. 0,008 mol; β. 0,001 mol; ή γ. 0,016 mol; |
• Τάση ατμών διαφόρων ουσιών στους 25 oC
Βρασμό έχουμε όταν η τάση ατμών σε μια φυσαλίδα εξισωθεί με την ατμοσφαιρική πίεση. |
Αέρια - Νόμος μερικών πιέσεων του DaltonΣτις αρχές του 19ου αιώνα ο Dalton οδηγήθηκε πειραματικά στο συμπέρασμα, ότι η πίεση η οποία ασκείται από ένα αέριο, όταν αυτό βρίσκεται σε μίγμα με άλλα αέρια, δεν εξαρτάται από την παρουσία των άλλων αερίων. Σήμερα βέβαια γνωρίζουμε ότι αυτό αφορά μόνο τα ιδανικά αέρια.
P = p A + p B + ....
 ΣΧΗΜΑ 1.11 Η πίεση ενός αερίου οφείλεται στις συγκρούσεις των μορίων του με τα τοιχώματα του δοχείου. Η ολική πίεση προφανώς εκφράζει το σύνολο των συγκρούσεων, δηλαδή P = p A + p B Πρέπει να τονιστεί ότι εκείνο που μετράται συνήθως πειραματικά, είναι
η ολική πίεση του αερίου μίγματος. Όμως, η καταστατική εξίσωση των
ιδανικών αερίων μπορεί να εφαρμoστεί τόσο για το μίγμα, όσο και για το
κάθε αέριο συστατικό χωριστά (π.χ. Α), με βάση τις ποσότητες mol nολ. και nA, αντίστοιχα : pA = χΑ P |
 Ο John Dalton (1776-1874) γιος φτωχού Άγγλου υφαντουργού. Έγινε δάσκαλος από ηλικία 12 ετών. Αργότερα διορίστηκε καθηγητής μαθηματικών και φυσικής σε κολέγιο του Μάντσεστερ. Η αγάπη του για τη μετεωρολογία τον οδήγησε στη μελέτη των αερίων, καρπός της οποίας ήταν η «Ατομική Θεωρία» και ο «Νόμος των Μερικών Πιέσεων».
• Μονάδες Πίεσης Μονάδες SI :Pascal (Pa) Συμβατικές μονάδες
 Η ατμοσφαιρική πίεση ισούται με την πίεση που ασκεί στήλη αέριας μάζας 104 kg σε επιφάνεια εμβαδού 1 m2. |
όπου χΑ το γραμμομοριακό κλάσμα του συστατικού Α του μίγματος. Κατ’ αυτό τον τρόπο υπολογίζονται οι μερικές πιέσεις των συστατικών του μίγματος. Δηλαδή:
Μια ενδιαφέρουσα εφαρμογή του νόμου μερικών πιέσεων γίνεται κατά τη συλλογή αερίων με εκτόπιση νερού ή άλλου υγρού, όπως φαίνεται στο σχήμα 1.12. To αέριο, καθώς συλλέγεται στον υποδοχέα, αναμιγνύεται με τους ατμούς του νερού. Η ολική πίεση του μίγματος αυτού είναι το άθροισμα της μερικής πίεσης του συλλεγόμενου αερίου και της μερικής πίεσης των υδρατμών (ή καλύτερα της τάσης ατμών του νερού) στη θερμοκρασία του πειράματος. Δηλαδή, P = pαερίου + p H2O
|
• Γραμμομοριακό κλάσμα
|
ΣΧΗΜΑ 1.12 Συλλογή αερίου πάνω από νερό και μέτρηση του όγκου του. Η
διάταξη δείχνει τη συλλογή αερίου κατά θερμική διάσπαση ενός στερεού π.χ. KClO3 2KClO3 → 2KCl + 3O2(g) Υπάρχουν πολλοί τρόποι για τη μέτρηση της πίεσης ενός αερίου. Ενδεικτικά αναφέρουμε τους μετρητές πίεσης στους σταθμούς καυσίμων, για τον έλεγχο της πίεσης στα λάστιχα των αυτοκινήτων. Στο εργαστήριο πολλές φορές γίνεται χρήση ενός μανόμετρου, όπως αυτά που εικονίζονται στο σχήμα 1.13. Η αρχή λειτουργίας ενός μανόμετρου είναι ανάλογη με αυτή ενός βαρομέτρου, που χρησιμοποιείται για τη μέτρηση της ατμοσφαιρικής πίεσης (βλέπε διπλανό σχήμα).
|
Βαρόμετρο: όργανο για τη μέτρηση της ατμοσφαιρικής πίεσης. Η στήλη του υδραργύρου ισορροπεί λόγω της ατμοσφαιρικής πίεσης. |
ΣΧΗΜΑ 1.13 Το Μανόμετρο είναι όργανο για τη μέτρηση της πίεσης. Υπάρχουν δύο
βασικοί τύποι μανομέτρων:
Παράδειγμα 1.4 Σε δοχείο όγκου 4,1 L έχουμε ποσότητες CO2 και CO με μερικές πιέσεις
αντίστοιχα 2 atm, και 3 atm στους 227 °C. ΛΥΣΗ Εφαρμογή |
|
| Σε δοχείο όγκου 16,4 L έχουμε ποσότητες Ν2 και Ο2 με μερικές πιέσεις
αντίστοιχα 16 atm και 4 atm στους 127 °C. α. Ποια είναι η ολική πίεση στο δοχείο; β. Ποιος είναι ο συνολικός αριθμός των mol στο αέριο μίγμα; γ. Πόσα mol Ν2 περιέχονται στο μίγμα; |
α. 20 atm, β. 10 mol, γ. 8 mol |