ΠΙΝΑΚΑΣ 1.3: Ατομικότητες στοιχείων
ΜΟΝΟΑΤΟΜΙΚΑ: Ευγενή αέρια: He, Ne, Ar, Kr, Xe, Rn, και τα μέταλλα σε κατάσταση ατμών.
Επίσης, στις χημικές εξισώσεις γράφονται σαν μονοατομικά τα στοιχεία C, S και P. |
| ΔΙΑΤΟΜΙΚΑ: Η2, O2, Ν2, F2, Cl2, Br2, I2. |
| ΤΡΙΑΤΟΜΙΚΑ: O3. |
| ΤΕΤΡΑΤΟΜΙΚΑ: Ρ4, As4, Sb4. |
Ιόντα
Τα άτομα είναι ηλεκτρικά ουδέτερα, αφού όπως θα δούμε πιο κάτω έχουν ίδιο αριθμό πρωτονίων και ηλεκτρονίων. Τα άτομα όμως μπορούν να μετατραπούν σε ιόντα με αποβολή ή με πρόσληψη ενός ή περισσοτέρων ηλεκτρονίων.
- Ιόντα είναι είτε φορτισμένα άτομα (μονοατομικά ιόντα), π.χ. Να+, Ca2+, S2-, Cl- είτε φορτισμένα συγκροτήματα ατόμων (πολυατομικά ιόντα), π.χ. ΝΗ4+, CO32-, Η2ΡO4- .
Τα ιόντα που έχουν θετικό ηλεκτρικό φορτίο ονομάζονται κατιόντα, π.χ. Na+, και εκείνα που έχουν αρνητικό ηλεκτρικό φορτίο ονομάζονται ανιόντα., π.χ. Cl-. Τα ιόντα αποτελούν τα δομικά σωματίδια των ιοντικών ή ετεροπολικών ενώσεων, που θα εξετάσουμε παρακάτω.
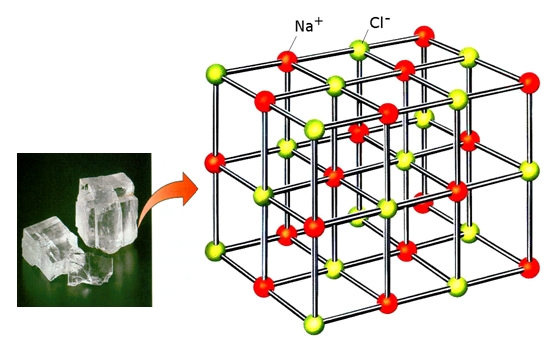 |
| ΣΧΗΜΑ 1.7 Ο κρύσταλλος του NaCl συγκροτείται από ιόντα Na+ και Cl-. |
|