3-2 ΟΙ ΝΟΜΟΙ ΤΩΝ ΑΕΡΙΩΝ
H κατάσταση στην οποία βρίσκεται ένα αέριο περιγράφεται μακροσκοπικά από την πίεση, τον όγκο και τη θερμοκρασία του.
Τα μεγέθη αυτά (πίεση - όγκος - θερμοκρασία) για ορισμένη ποσότητα αερίου δεν είναι ανεξάρτητα μεταξύ τους αλλά συσχετίζονται. Για παράδειγμα, αν αυξήσουμε τη θερμοκρασία σε μια κλειστή φιάλη που περιέχει αέριο θα αυξηθεί και η πίεση.
Οι σχέσεις που συνδέουν τα μεγέθη αυτά προσδιορίστηκαν πειραματικά και αποτελούν τους νόμους των αερίων.
Νόμος του Boyle (Μπόιλ, 1627-1691)
Η πίεση ορισμένης ποσότητας αερίου του οποίου η θερμοκρασία παραμένει σταθερή είναι αντίστροφα ανάλογη με τον όγκο του.
Η μαθηματική διατύπωση είναι:
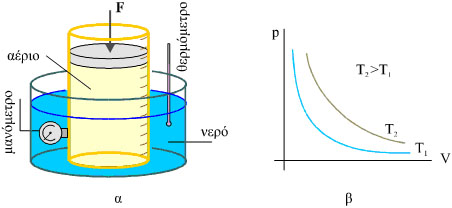
Η μεταβολή στην οποία η θερμοκρασία παραμένει σταθερή ονομάζεται ισόθερμη. |
Σχ. 3.1 α) To αέριο βρίσκεται μέσα σε ογκομετρικό δοχείο. Το δοχείο με το αέριο περιβάλλεται από λουτρό με νερό του οποίου η θερμοκρασία διατηρείται σταθερή. Στο δοχείο υπάρχει προσαρμοσμένο μανόμετρο για τη μέτρηση της πίεσης του αερίου. β) Στο διάγραμμα παριστάνεται γραφικά η πίεση του αερίου σε συνάρτηση με τον όγκο του, για θερμοκρασίες Τ1 και Τ2 για τις οποίες ισχύει Τ2 > Τ1. |
Σχ. 3.2 α) Το αέριο βρίσκεται μέσα σε δοχείο σταθερού όγκου. Καθώς θερμαίνεται αυξάνεται η πίεσή του. β) Στο διάγραμμα παριστάνεται γραφικά η μεταβολή της πίεσης σε συνάρτηση με τη θερμοκρασία, για δύο διαφορετικές τιμές του όγκου V1 και V2 με V1<V2.
|
Ο νόμος του Charles (Σαρλ, 1746-1823)
Η πίεση ορισμένης ποσότητας αερίου του οποίου ο όγκος διατηρείται σταθερός είναι ανάλογη με την απόλυτη θερμοκρασία του αερίου.
Η μαθηματική του διατύπωση είναι:
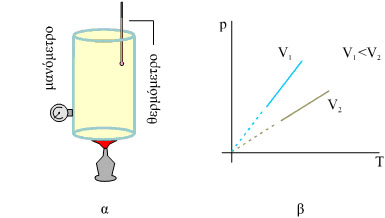 Η μεταβολή στην οποία ο όγκος παραμένει σταθερός ονομάζεται ισόχωρη.
Στο σχήμα 1.2.β οι διακεκομμένες γραμμές υποδηλώνουν ότι η ευθεία της γραφικής παράστασης προεκτεινόμενη περνάει από την αρχή των αξόνων. Το διακεκομμένο τμήμα της ευθείας αντιστοιχεί σε θερμοκρασίες στις οποίες τα αέρια δεν υπακούουν στο νόμο.
Τη θερμοκρασία τη μετράμε σε βαθμούς Κέλβιν (Κ). Η θερμοκρασία αυτή ονομάζεται απόλυτη θερμοκρασία.
Η θερμοκρασία στην κλίμακα Κelvin προκύπτει αν στη θερμοκρασία θ, μετρημένη στην κλίμακα Κελσίου, προσθέσουμε το 273. Τ=273 + θ.
Το μηδέν της κλίμακας Kelvin αντιστοιχεί στους –273 oC και είναι η θερμοκρασία κάτω από την οποία είναι αδύνατο να φτάσουμε. Τη θερμοκρασία αυτή τη λέμε και «απόλυτο μηδέν ».
Ο νόμος του Gay – Lussac (Γκέι-Λουσάκ, 1778-1850)
Ο όγκος ορισμένης ποσότητας αερίου, όταν η πίεσή του διατηρείται σταθερή, είναι ανάλογος με την απόλυτη θερμοκρασία του.
Η μαθηματική διατύπωση του νόμου είναι:
|
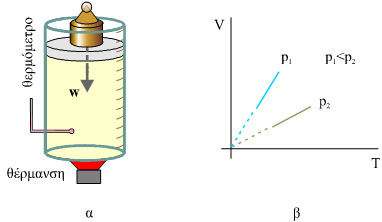
Η μεταβολή στην οποία η πίεση παραμένει σταθερή ονομάζεται ισοβαρής.
Ιδανικά αέρια
Οι τρεις προηγούμενοι νόμοι ισχύουν για τα διάφορα αέρια με μικρές ή μεγάλες αποκλίσεις. Συγκεκριμένα ισχύουν με μεγαλύτερη ακρίβεια για ένα μονοατομικό παρά για ένα πολυατομικό αέριο που βρίσκεται στις ίδιες συνθήκες. Επίσης ισχύουν με μεγαλύτερη ακρίβεια για τα θερμά και αραιά αέρια από ό,τι για τα πυκνά και ψυχρά. Ας υποθέσουμε τώρα ότι κάποιο αέριο υπακούει με ακρίβεια στους νόμους αυτούς ανεξάρτητα από το αν είναι θερμό ή ψυχρό, πυκνό ή αραιό. Ένα τέτοιο αέριο ακριβώς επειδή στην πραγματικότητα δεν υπάρχει θα ονομάζεται ιδανικό αέριο. Μακροσκοπικά ιδανικό αέριο, είναι αυτό που υπακούει στους τρεις νόμους των αερίων σε οποιεσδήποτε συνθήκες κι αν βρίσκεται.
|
Σχ. 3.3 α) Καθώς το αέριο θερμαίνεται ο όγκος του αυξάνεται. Η πίεση του αερίου διατηρείται σταθερή με ένα βάρος τοποθετημένο πάνω στο έμβολο. β) Στο διάγραμμα παριστάνεται γραφικά η μεταβολή του όγκου σε συνάρτηση με τη θερμοκρασία, για δυο τιμές της πίεσης p1 και p2 με p1 < p2.
|