Αραίωση ρυθμιστικού διαλύματος
Αν έχουμε ρυθμιστικό διάλυμα: ΗΑ c1 M και NaA c2 M
τότε ισχύει, [H3O+] = Ka c1/c2
Αν αραιώσουμε το διάλυμα 10 φορές με νερό, τότε το διάλυμα που θα προκύψει θα περιέχει: ΗΑ 0,1c1 M και NaA 0,1c2 M οπότε,
[H3O+] = Ka (0,1c1) /(0.1c2) = Ka c1/c2
Παρατηρούμε δηλαδή ότι κατά την αραίωση, το pH του ρυθμιστικού διαλύματος παραμένει σταθερό. Αυτό βέβαια με την προϋπόθεση ότι ισχύουν οι προσεγγίσεις που απαιτούνται για την εφαρμογή της σχέσης:
[H3O+] = Ka cοξέος / cβάσης
Όταν, με συνεχή αραίωση, φτάσουμε στο σημείο να μη ισχύουν οι προϋποθέσεις για την εφαρμογή της παραπάνω σχέσης, τότε το διάλυμα χάνει τη ρυθμιστική του ικανότητα.
Παράδειγμα 5.16
1. Σε 100 ml H 2O προσθέτουμε 0,001 mol HCl. Να υπολογιστεί η συγκέντρωση των Η 3Ο + στο Η 2Ο και στο διάλυμα και να γίνει η σύγκριση μεταξύ τους.
2. Σε 100 ml διαλύματος Α που περιέχει HF 1 M και NaF 0,5 Μ προσθέτουμε 0,001 mol HCl και παίρνουμε διάλυμα Β. Να βρεθεί η συγκέντρωση Η 3Ο + στο Α και στο Β και να συγκριθούν μεταξύ τους. Δίνεται K a HF = 10 -4.
ΛΥΣΗ
1. Στο καθαρό Η 2Ο και στους 25 oC γνωρίζουμε ότι [Η 3Ο +] = 10 -7 M .Το διάλυμα HCl έχει 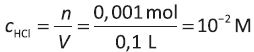
Το HCl ιοντίζεται πλήρως άρα [Η 3Ο +] = 10 -2 Μ. Δηλαδή, αυξήθηκε η [Η 3Ο +] κατά την προσθήκη του HCl στο Η 2Ο κατά 100.000 φορές.
2. Το διάλυμα A είναι ρυθμιστικό. Συνεπώς έχουμε :
κατά την προσθήκη του HCl γίνεται η αντίδραση:
| |
HCl + |
NaF → |
NaCl + |
HF |
| αρχικά / mol |
0,001 |
0,05 |
- |
0,1 |
| αντ. – παράγ. |
0,001 |
0,001 |
0,001 |
0,001 |
| τελικά / mol |
- |
0,049 |
0,001 |
0,101 |
To διάλυμα Β περιέχει NaCl, που δεν επηρεάζει το pH του διαλύματος, και HF 0,101 mol και NaF 0,049 mol. Συνεπώς έχουμε:
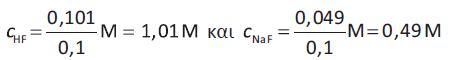
Το διάλυμα Β είναι ρυθμιστικό, οπότε έχουμε:
|