Γι’ αυτό η ισχύς των οξέων αυξάνεται κατά τη σειρά:
Η-CH3 < H-ΝΗ2 < Η-ΟH < H-F
Δηλαδή, όσο πιο ηλεκτραρνητικό είναι το άτομο Χ, τόσο πιο ισχυρά έλκει προς το μέρος του τα ηλεκτρόνια του δεσμού Η-Χ, διευκολύνοντας έτσι την απόσπαση του Η+. Επίσης,
- Σε μια δεδομένη ομάδα του περιοδικού πίνακα, η ισχύς του οξέων αυξάνεται από πάνω προς τα κάτω, κατά την ίδια σειρά που αυξάνεται η ατομική ακτίνα στοιχείου Χ που ενώνεται με το Η.
Για παράδειγμα η ισχύς των υδραλογόνων ακολουθεί την σειρά:
HF < HCl < HBr < HI.
Αυτό δικαιολογείται με το σκεπτικό ότι, καθώς μεγαλώνει η ατομική ακτίνα του Χ, ο δεσμός Η-Χ εξασθενίζει, με αποτέλεσμα ευκολότερα να αποσπάται το Η+ .
Σημαντικό ρόλο στη συσχέτιση μοριακής δομής και ισχύος ηλεκτρολύτη αποτελεί το επαγωγικό φαινόμενο. Επαγωγικό φαινόμενο ονομάζεται η μετατόπιση των ηλεκτρονίων (πόλωση) ενός δεσμού, λόγω της παρουσίας γειτονικών ομάδων ή ατόμων.
Οι υποκαταστάτες (άτομα ή ομάδες ατόμων) που έλκουν ηλεκτρόνια, π.χ. αλογόνα προκαλούν το -Ι επαγωγικό φαινόμενο. Η σειρά αύξησης του –Ι επαγωγικού φαινομένου για μια σειρά υποκαταστατών είναι:
C6H5- < -NH2 < -OH < -I < -Br < -Cl < -F < -CN < -ΝΟ2.
- Το -Ι επαγωγικό φαινόμενο πολώνει εντονότερα το δεσμό Η-Χ με αποτέλεσμα, να αποσπάται ευκολότερα το Η+, δηλαδή ευνοεί την ισχύ του οξέος.
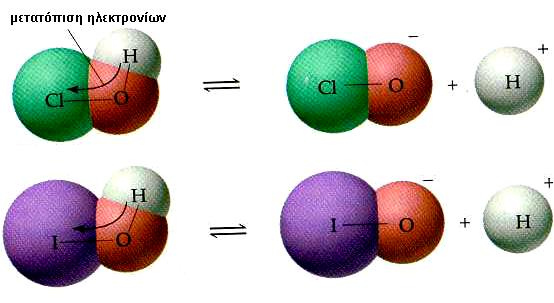
ΣΧΗΜΑ 5.6 Το πιο ηλεκτραρνητικό άτομο, δηλαδή το χλώριο, «τραβά» εντονότερα το ζευγάρι ηλεκτρονίων του δεσμού Ο-Η, απ’ ότι το ιώδιο. Το χλώριο, δηλαδή, προκαλεί εντονότερο -Ι επαγωγικό φαινόμενο σε σύγκριση με το ιώδιο Έτσι, ο δεσμός Ο-Η γίνεται ασθενέστερος στην περίπτωση του HClO και η απόσπαση του Η+ γίνεται ευκολότερα. Γι’ αυτό και το HClO είναι ισχυρότερο οξύ από το HIO.
Με ανάλογους κανόνες καθορίζεται ο βασικός χαρακτήρας των ηλεκτρολυτών. Έτσι,
- Ο βασικός χαρακτήρας των υδρογονούχων ενώσεων αυξάνεται από δεξιά προς τα αριστερά και από κάτω προς τα πάνω στο περιοδικό πίνακα.
Έτσι για παράδειγμα, η ισχύς των βάσεων σε υδατικό διάλυμα ακολουθεί τη σειρά: NH3 > PH3 > AsH3 > SbH3 > BiH3, καθώς με αυτή τη σειρά μειώνεται η ατομική ακτίνα του στοιχείου Χ που ενώνεται με το Η.
|