25. Λ, Λ, Σ, Σ, Σ
31. α. Λ β. Σ γ. Σ δ. Λ
33. α.1s (1, 0, 0)
β.3px (3,1,1)
γ. 2pz (2,1,0)
δ.2s (2,0,0)
ε.3s (3,0,0)
34. δ
35. α, γ, δ, στ
36. 2py, 3s, 4px
37. 1, 3, 5, 7
38. (3, 1,-1, ±1/2)
(3, 1, 0, ±1/2)
(3, 1, 1, ±1/2)
39. γ
40. 5s , 4d, 6s , 4f, 5d
41. δ
42. γ
45. α.1s2, β.1s2 2s2 2p3
γ.1s2 2s2 2p6 3s1
δ. [Ar] 3d104s2 4p3
ε. [Ne] 3s2 3p5
46. 1s2 2s2 2p2
(1, 0, 0, +1/2) |
(1, 0, 0, -1/2)
(2, 0, 0, +1/2)
(2, 0, 0, -1/2)
(2, 1, 1, -1/2)
(2, 1, 0, -1/2)
47. οι α, ζ δεν υπακούουν στον Pauli και β, δ, ε στο Hund.
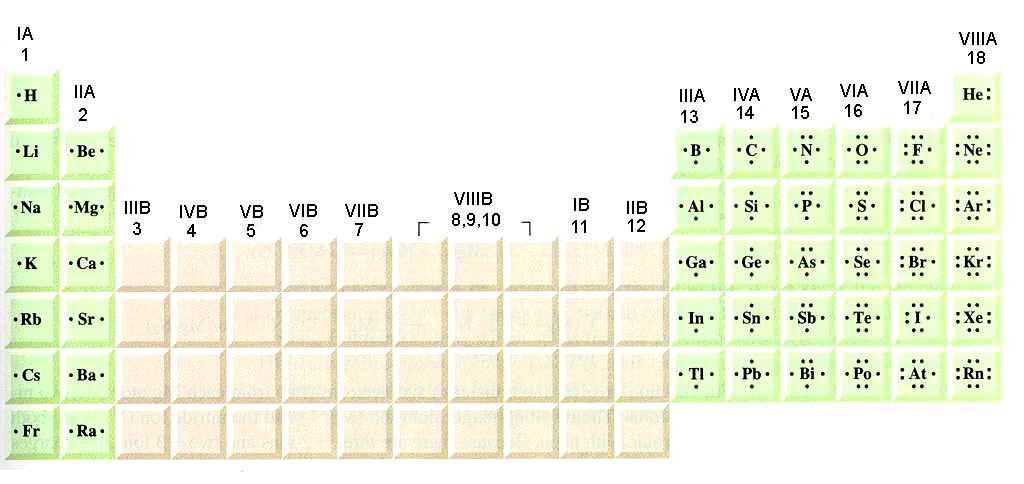
51. 17Cl (3η περίοδος, τομέας p)
22Τi (4η περ., τομ. d)
36Kr(4η περ., τομ. p)
58Ce (6η περ., τομ. f)
52. V, Co, Zr
53. 24B, 41Ω
58. α. Σ β. Λ γ. Σ δ. Λ
59. Na, Rb, Rb
60. Περισσότερη ενέργεια χρειάζεται για να απομακρυνθεί ένα 1s e- από ότι ένα 2s e-.
|
61. Με πρόσληψη 1 e- το άτομο του F αποκτά δομή ευγενούς αερίου
Mε πρόσληψη 1 e- από το άτομο του Ne φεύγει από τη δομή ευγενούς αερίου
70. β
71. δ
72. γ
74. 3p < 3d < 4s
75. ΙΙΑ
76. Ο διεγερμένο, Br σε θεμελιώδη κατάσταση, P διεγερμένο, Ιn σε θεμελιώδη κατάσταση.
77. α. 7Ν3- β. Ca2+ γ. Fe2+
78. Γραμμικό
79. α. Α, β. Ζ, γ. Ε, δ. Δ, ε. Γ, στ. Ε, ζ. Κ
80. Α
|