Παράδειγμα 5.18
Διάλυμα ισχυρού μονοπρωτικού οξέος ΗΑ όγκου 500 mL και άγνωστης περιεκτικότητας ογκομετρείται με πρότυπο διάλυμα NaOH 0,2 M. Μετρήσεις του pH με τη βοήθεια πεχαμέτρου οδήγησε στον παρακάτω πίνακα:
NaOH
/ mL |
2,0 |
4,0 |
6,0 |
8,0 |
9,0 |
9,9 |
10 |
10,1 |
11 |
12 |
| pH |
2,50 |
2,62 |
2,81 |
3,10 |
3,41 |
4,41 |
7,00 |
9,60 |
10,6 |
10,9 |
α. Να χαράξετε την καμπύλη ογκομέτρησης.
β. Ποια είναι η συγκέντρωση του διαλύματος του ΗΑ;
γ. Ποιο δείκτη θα διαλέγατε, ανάμεσα σ’ αυτούς που δίνονται παρακάτω, για την ογκομέτρηση. Δίνονται οι περιοχές αλλαγής χρώματος αυτών: ηλιανθίνη (pH : 3 - 4,5), μπλε της βρωμοθυμόλης (pH : 6 - 7,5), φαινολοφθαλεΐνη ( pH : 8 - 10).
ΛΥΣΗ
α. Με βάση τα δεδομένα η καμπύλη ογκομέτρησης είναι:
β. Στο ισοδύναμο σημείο, το διάλυμα θα περιέχει μόνο NaA (άλας που προκύπτει από ισχυρό οξύ με ισχυρή βάση) και επομένως θα έχει pH = 7. Συνεπώς, όπως φαίνεται από τη καμπύλη αντίδρασης, η εξουδετέρωση του οξέος ΗΑ γίνεται με 10 mL διαλύματος NaOH 0,2 M που περιέχουν 0,002 mol NaOH. Αν θεωρήσουμε ότι η Molarity του διαλύματος ΗΑ είναι c M, τότε έχουμε:ΗΑ + NaOH → NaA + H 2O
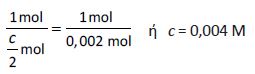
Άρα η Molarity του διαλύματος ΗΑ είναι 0,004 Μ.
γ. Διαλέγουμε δείκτη του οποίου το πεδίο pH αλλαγής χρώματος περιλαμβάνει το pH του ισοδύναμου σημείου, δηλαδή το 7. Τέτοιος δείκτης είναι το μπλε της βρωμοθυμόλης.
|