Παρασκευές
Τα αλκάνια, ως φυσικές πρώτες ύλες, δεν παράγονται βιομηχανικά. Αντίθετα, αποτελούν τις πρώτες ύλες για την παραγωγή άλλων ενώσεων (πετροχημεία). Τα απλούστερα αλκάνια (μεθάνιο έως πεντάνιο) μπορούν να παραχθούν σε καθαρή κατάσταση με κλασματική απόσταξη του πετρελαίου ή του φυσικού αερίου. Τα υπόλοιπα αλκάνια μπορούν να συντεθούν με μια από τις μεθόδους που περιγράφονται παρακάτω, οι οποίες έχουν καθαρό εργαστηριακό χαρακτήρα.
Γενικές παρασκευές αλκανίων
1. Από τα αλκυλαλογονίδια RX με αντικατάσταση του αλογόνου από υδρογόνο.
RX + H2 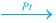 RH + HX RH + HX
Από τα αλκυλαλογονίδια δραστικότερα είναι τα αλκυλοιωδίδια, ακολουθούν τα αλκυλοβρωμίδια και αλκυλοχλωρίδια, ενώ τα αλκυλοφθορίδια είναι τελείως αδρανή.
π.χ. CH3I + H2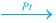 Ch4 + HI Ch4 + HI
2. Με επίδραση νατρίου σε αλκυλαλογονίδια διαλυμένα σε ξηρό αιθέρα (μέθοδος Wurtz).
2RX + 2Na 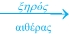 R-R + 2NaX R-R + 2NaX
π.χ. 2CH3Br + 2Na → CH3CH3 + 2NaBr
3. Με θέρμανση των με νάτριο ή κάλιο αλάτων κορεσμένων μονοκαρβοξυλικών οξέων (RCOONa ή RCOOK) με στερεό NaOH ή ΚΟΗ.
RCOONa + NaOH  RH + Na2CO3 RH + Na2CO3
Η μέθοδος αυτή ονομάζεται αποκαρβοξυλίωση και το αλκάνιο που προκύπτει έχει 1 άτομο C λιγότερο από το άλας.
π.χ. CH3COONa + NaOH  CH4 + Na2CO3 CH4 + Na2CO3
4. Με καταλυτική υδρογόνωση ακόρεστων υδρογονανθράκων
π.χ. CvH2v + H2 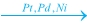 CvH2v+2 CvH2v+2
Φυσικές ιδιότητες
Τα κατώτερα μέλη των αλκανίων (C1 - C4) είναι αέρια, άχρωμα, άοσμα και αδιάλυτα στο νερό. Τα μέσα μέλη (C5 - C16) είναι υγρά με χαρακτηριστική οσμή πετρελαίου και τα ανώτερα (C17 και άνω) είναι στερεά, άχρωμα με υφή κεριού, όπως η βαζελίνη.
Χημικές ιδιότητες
Το CH4 και όλα τα αλκάνια είναι αδρανείς ενώσεις. Σε κατάλληλες όμως συνθήκες μπορούν να δώσουν ορισμένες αντιδράσεις, σημαντικότερες από τις οποίες είναι: η καύση, η πυρόλυση και η υποκατάσταση.
α. Καύση 
Τα αλκάνια καίγονται με περίσσεια οξυγόνου (ή αέρα) προς |