ΕΝΘΕΤΟΈννοιες που εξετάζονται
από
|
ΟΜΟΙΟΠΟΛΙΚΟΙ ΔΕΣΜΟΣ -
|
ΝΕΡΟ:
|
2. Αναπτύσσει ισχυρές δυνάμεις συνοχής και συνάφειας και έχει μεγάλη επιφανειακή τάση. Αν αφήσεις με προσοχή ένα ξυραφάκι στην ελεύθερη επιφάνεια ενός ποτηριού με νερό, θα παρατηρήσεις ότι αυτό επιπλέει. Μπορείς επίσης εύκολα να διαπιστώσεις ότι δύο αντικειμενοφόρες πλάκες ανάμεσα στις οποίες έχει παρεμβληθεί νερό δύσκολα αποχωρίζονται. Τα δύο αυτά φαινόμενα είναι αποτέλεσμα των ισχυρών δυνάμεων που ασκούνται μεταξύ των μορίων του νερού. Οι ίδιες δυνάμεις εμφανίζονται και μεταξύ των μορίων του νερού και μορίων άλλων χημικών ενώσεων, που έχουν υδρόφιλο χαρακτήρα. Πράγματι τα μόρια του νερού, χάρη στον πολικό χαρακτήρα τους, έλκονται μεταξύ τους με ισχυρές δυνάμεις, που ονομάζονται δυνάμεις συνοχής. Λόγω των σχετικά ισχυρών δυνάμεων συνοχής το νερό ανθίσταται στην παραμόρφωση της ελεύθερης επιφάνειάς του, δηλαδή παρουσιάζει μεγάλη επιφανειακή τάση. Η μεγάλη επιφανειακή τάση του νερού εξηγεί το γεγονός ότι μερικά έντομα περπατούν στην επιφάνειά του χωρίς να βυθίζονται. Οι δυνάμεις που αναπτύσσονται μεταξύ των μορίων του νερού και των μορίων άλλων σωμάτων (π.χ. νερό - γυαλί) λέγονται δυνάμεις συνάφειας. Χάρη σ' αυτές διατηρούνται υγρές οι επιφάνειες των κυτταρικών μεμβρανών, τα σπέρματα απορροφούν νερό και βλαστάνουν κ.ά. Με το συνδυασμό των δυνάμεων συνοχής' και συνάφειας (τριχοειδή φαινόμενα) επιτυγχάνεται η ανύψωση του νερού από τη ρίζα στο βλαστό και στα φύλλα των φυτών. 3. Έχει μεγαλύτερη πυκνότητα στην υγρή απ' όση στη στερεή κατάσταση. Όλα τα υγρά παρουσιάζουν ελάττωση του όγκου τους με την ψύξη. Το νερό όμως παρουσιάζει μια ιδιαιτερότητα.
Ως αποτέλεσμα των δεσμών υδρογόνου, τα μόρια του νερού προσκολλώνται σε άλλα μόρια νερού (δυνάμεις συνοχής). Τα μόρια του νερού επίσης σχηματίζουν δεσμούς υδρογόνου με άλλα μόρια (δυνάμεις συνάφειας). Τελικά το νερό κινείται προς τα πάνω μέσω των λεπτών αγγείων του φυτού (τριχοειδές φαινόμενο).
Κάτω από τη θερμοκρασία των 4°C ο όγκος του, αντί να ελαττώνεται, αυξάνεται. Έτσι στους 4°C, που το νερό είναι ακόμη υγρό, έχει μεγαλύτερη πυκνότητα από ότι στους 0°C, που έχει μετατραπεί σε πάγο. Για το λόγο αυτό ο πάγος δε βυθίζεται στο νερό και αποφεύγεται έτσι το πάγωμα του πυθμένα των θαλασσών και όλης της υπόλοιπης μάζας του νερού των λιμνών και των θαλασσών, που θα θανάτωνε τους υδρόβιους οργανισμούς.
Το παγωμένο νερό είναι λιγότερο πυκνό από το υγρό νερό, γιατί οι δεσμοί υδρογόνου στον πάγο δημιουργούν ένα σταθερό, ανοιχτό πλέγμα. Εξαιτίας αυτού το λιγότερο πυκνό (σταθερό) υλικό επιπλέει πάνω στο περισσότερο πυκνό νερό. Εξασφαλίζεται έτσι τόπος συνάντησης για τους πιγκουίνους (ή φώκιες). |
4. Έχει μεγάλη διαλυτική ικανότητα. Μια από τις ανεπιτυχείς προσπάθειες των αλχημιστών του Μεσαίωνα ήταν η ανακάλυψη ενός διαλύτη ικανού να διαλύει όλες τις υπάρχουσες ουσίες. Οι προσπάθειες αυτές ποτέ δε στέφθηκαν με επιτυχία. Έμεινε ωστόσο η γνώση ότι το νερό, αν και δεν είναι ο απόλυτος διαλύτης, μπορεί να διαλύσει ένα πλήθος διαφορετικών ουσιών. Χημικές ενώσεις του κυττάρου, όπως τα λιπίδια, που δε διαλύονται στο νερό (μη πολικές ενώσεις), επειδή έχουν την τάση να απομακρύνονται από τα μόρια του νερού και να συσσωματώνονται μεταξύ τους, χαρακτηρίζονται ως υδρόφοβες ενώσεις. Όπως θα δούμε αργότερα, η τάση αυτή είναι σημαντική για το σχηματισμό των βιολογικών μεμβρανών. Το νερό, χάρη στη μεγάλη διαλυτική του ικανότητα, αποτελεί ένα εξαιρετικό μέσο μεταφοράς ουσιών στο κυκλοφορικό και στο απεκκριτικό σύστημα των ζώων και στους αγωγούς ιστούς των φυτών. Παράλληλα όμως διευκολύνει τη διεξαγωγή των χημικών αντιδράσεων, διότι οι ουσίες που βρίσκονται σε διάλυμα κινούνται περισσότερο ελεύθερα απ' όσο σε στερεά κατάσταση. Η κίνηση αυτή εξασφαλίζει μεγαλύτερη χημική δραστικότητα. 5. Διίσταται σε ιόντα. Ένα ακόμη χαρακτηριστικό του νερού, σημαντικό για τη ζωή, είναι η διάσταση του σε κατιόντα υδρογόνου Η+ και σε ανιόντα υδροξυλίου ΟΗ -, σύμφωνα με την εξίσωση (Η2Ο ↔ Η++ ΟΗ-). Επειδή όμως η διάσταση του νερού σε ιόντα γίνεται ταυτόχρονα με την επανένωση των ιόντων σε μόρια νερού, ένας ελάχιστος αριθμός μορίων νερού (1 στα 554 εκατομμύρια μόρια) βρίσκεται πρακτικά σε διάσταση. ΕΝΕΡΓΟΣ ΟΞΥΤΗΤΑ (pΗ)Ο όρος pΗ χρησιμοποιήθηκε για πρώτη φορά από το Δανό βιοχημικό S.P.L. Sorenson, στο πλαίσιο μιας ερευνάς του για καλύτερες συνθήκες ζύμωσης της μπίρας. Η οξύτητα ενός διαλύματος είναι το αποτέλεσμα των ελεύθερων ιόντων υδρογόνου (Η+). Η συγκέντρωση των ιόντων αυτών είναι συχνά πολύ χαμηλή. Το ξίδι, για παράδειγμα, έχει συγκέντρωση των ιόντων υδρογόνου 0.001 mol.dm-3. Ο Sorenson
Αποδιάταξη των δεσμών υδρογόνου που αναπτύσσονται μεταξύ των μορίων του νερού, όταν αυτό είναι υγρό.
σκέφτηκε ότι το 0.001 μπορεί να γραφεί ως 10-3 και το 0.00000000000001 ως 10-14. Στη συνέχεια, για ευκολία, επειδή οι αριθμοί αυτοί είναι δύσχρηστοι, αγνόησε το 10 και το μείον και κράτησε το 3 και το 14 αντίστοιχα. Η διάσταση του νερού, παρά το ότι είναι αντιστρεπτή και συμβαίνει σε μικρό ποσοστό μορίων, παίζει σημαντικό ρόλο στο φαινόμενο της ζωής, καθώς τόσο η δομή (και συνεπώς η λειτουργία των διάφορων ειδών μακρομορίων) όσο και πολλές από τις δραστηριότητες των κυττάρων επηρεάζονται άμεσα από τις συγκεντρώσεις των Η+ και των ΟΗ -.
Διάφορα υλικά με διαφορετικό pH. |
ΔΙΑΧΥΣΗΑν σε ένα ποτήρι με νερό προστεθεί μια σταγόνα νερομπογιάς, σε λίγο όλη η ποσότητα του νερού θα είναι χρωματισμένη. Τι είναι αλήθεια αυτό που κάνει τα μόρια της νερομπογιάς να διασπείρονται σε όλο το ποτήρι; Τα μόρια της νερομπογιάς, όπως όλα τα μόρια, βρίσκονται σε μια κατάσταση διαρκούς κίνησης, που είναι γνωστή ως θερμική κίνηση. Η μεμονωμένη κίνηση ενός μορίου νερομπογιάς είναι τυχαία. Το σύνολο όμως των μορίων της νερομπογιάς κατευθύνεται από την περιοχή υψηλής συγκέντρωσης προς την περιοχή όπου η συγκέντρωση
είναι χαμηλή. Έτσι δεν αργεί να χρωματιστεί ομοιόμορφα όλη η ποσότητα νερού στο ποτήρι. Τα μόρια της νερομπογιάς μετακινούνται «καθαρά» από το αριστερό τμήμα του διαλύματος, που έχει μεγαλύτερη συγκέντρωση, προς το δεξιό τμήμα, που έχει μικρότερη συγκέντρωση. Αυτό σημαίνει ότι μετακίνηση γίνεται και προς τις δύο κατευθύνσεις αλλά με μεγαλύτερο ρυθμό από την περιοχή υψηλής συγκέντρωσης προς την περιοχή χαμηλής συγκέντρωσης. Κάποτε εξισώνονται οι συγκεντρώσεις. Η μετακίνηση των μορίων όμως δε σταματά, αλλά γίνεται με τον ίδιο ρυθμό και προς τις δύο κατευθύνσεις.
ΩΣΜΩΣΗΣτο σωλήνα της εικόνας, του οποίου τα δύο μέρη χωρίζονται από μια ημιπερατή μεμβράνη, έχουν τοποθετηθεί, αριστερά, υδατικό διάλυμα σακχάρου και, δεξιά, καθαρό νερό. Η μεμβράνη, ενώ επιτρέπει τη διέλευση των μορίων του νερού, εμποδίζει τη διέλευση των μορίων του σακχάρου. Τα μόρια του νερού διαπερνούν τη μεμβράνη και διαχέονται από το αριστερό διάλυμα (είναι αραιότερο, επομένως αναλογικά περιέχει περισσότερα μόρια
νερού) προς το δεξιό (είναι πυκνότερο, επομένως αναλογικά περιέχει λιγότερα μόρια νερού), με αποτέλεσμα την αύξηση του όγκου του. Η μετακίνηση νερού από το αραιότερο διάλυμα (υποτονικό) προς το πυκνότερο διάλυμα (υπερτονικό) συνεχίζεται, ώσπου να εξισωθούν οι συγκεντρώσεις σακχάρου των δύο διαλυμάτων, που πλέον χαρακτηρίζονται ως ισοτονικά. Όταν συμβεί αυτό, τότε οι ρυθμοί με τους οποίους τα μόρια του νερού μετακινούνται από το ένα προς το άλλο διάλυμα εξισώνονται.
|
ΙΣΧΥΡΟΙ ΟΜΟΙΟΠΟΛΙΚΟΙ ΔΕΣΜΟΙ ΣΤΑ ΒΙΟΛΟΓΙΚΑ ΜΑΚΡΟΜΟΡΙΑ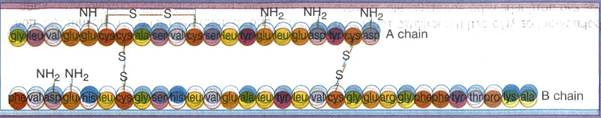
Μια κατηγορία χημικών δεσμών, που αναπτύσσονται μεταξύ των πλάγιων ομάδων R των αμινοξέων και μετέχουν μαζί με τις δυνάμεις Van der Waals στη διαμόρφωση της τριτοταγούς δομής των πρωτεϊνών, είναι οι δεσμοί S-S (θειογέφυρες). Πρόκειται για ισχυρούς ομοιοπολικούς δεσμούς. ΑΣΘΕΝΕΙΣ ΕΤΕΡΟΠΟΛΙΚΟΙ ΔΕΣΜΟΙ ΣΤΑ ΒΙΟΛΟΓΙΚΑ ΜΑΚΡΟΜΟΡΙΑΔυνάμεις Van der Waals (Βαν ντερ Βαλς). Γνωρίζουμε ότι τα e- κινούνται γύρω από τον πυρήνα δημιουργώντας το ηλεκτρονικό νέφος. Σε άτομα ορισμένων στοιχείων, όπως τα αλογόνα, λόγω της κίνησης αυτής παρατηρείται προσωρινή συγκέντρωση τους σε μια περιοχή του ατόμου. Το φαινόμενο αυτό έχει ως αποτέλεσμα ορισμένα άτομα αυτών των στοιχείων να μετατρέπονται σε παροδικά ηλεκτρικά δίπολα. Τα δίπολα άτομα επάγουν τη δημιουργία και άλλων τέτοιων δίπολων σε γειτονικά τους άτομα. Μεταξύ των δίπολων αναπτύσσονται ηλεκτρικές δυνάμεις, ελκτικές ή απωστικές. που ονομάζονται δυνάμεις Van der Waals (Βαν ντερ Βαλς). Τέτοιες δυνάμεις συμμετέχουν στη διαμόρφωση της τριτοταγούς δομής των πρωτεϊνών.
Υδρόφοβοι δεσμοί Όπως και οι δυνάμεις Van der Waals, είναι ασθενείς χημικοί δεσμοί. Δημιουργούνται, όταν το Η2Ο εξαναγκάζει τις υδρόφοβες ομάδες μορίων να προσεγγίζουν μεταξύ τους. Οι δεσμοί αυτοί έχουν ιδιαίτερη σημασία για το σχηματισμό των κυτταρικών μεμβρανών. ΤΟ ΦΑΣΜΑ ΑΠΟΡΡΟΦΗΣΗΣ ΜΙΑΣ ΟΥΣΙΑΣΕάν τοποθετήσουμε ένα χρωματιστό υγρό μέσα σε ειδικό δοχείο και το δοχείο αυτό τοποθετηθεί στην πορεία των φωτεινών ακτινών λευκού φωτός, θα απορροφήσει από το λευκό φως ορισμένα χρώματα. Εφόσον αναλύσουμε με ένα πρίσμα το υπόλοιπο φως που βγαίνει από το έγχρωμο υγρό θα πάρουμε το φάσμα απορρόφησής του.
Το φάσμα του ορατού φωτός. |