6. Tα αλογόναΌπως είδαμε στο κεφάλαιο για τα οξέα, τις βάσεις και τα άλατα, από το μαγειρικό αλάτι (χλωριούχο νάτριο, NaCl) πήρε το όνομά της μια ολόκληρη κατηγορία χημικών ενώσεων, τα άλατα. Τα χημικά στοιχεία που ανήκουν στη 17η ομάδα του περιοδικού πίνακα ονομάζονται αλογόνα, επειδή «γεννούν άλατα». Πράγματι, τα στοιχεία αυτά αντιδρούν εύκολα με τα περισσότερα μέταλλα και σχηματίζουν άλατα. Διαλύματα αλογόνων και ενώσεών τους συναντάμε συχνά στην καθημερινή μας ζωή. Το μαγικό καφετί βάμμα ιωδίου, που απολυμαίνει καθημερινά τις πληγές εκατομμυρίων ανθρώπων, είναι διάλυμα του αλογόνου ιωδίου, σε οινόπνευμα. Το πόσιμο νερό και το νερό στις πισίνες απολυμαίνεται με ένα άλλο αλογόνο, το χλώριο, και οι παππούδες των σύγχρονων φωτογραφιών, οι ασπρόμαυρες φωτογραφίες, οφείλουν την ύπαρξή τους σε ένα άλας ενός άλλου αλογόνου, του βρομίου. 
Έννοιες κλειδιά: αλογόνα • δυσδιάλυτα • καταβύθιση Όταν θα έχετε μελετήσει την ενότητα αυτή, θα μπορείτε:
|
Tα αλογόνα6.1 Γενικά
6.2 Φυσικές ιδιότητες των αλογόνωνΣτις συνήθεις συνθήκες το φθόριο και το χλώριο είναι αέρια, το βρόμιο είναι πτητικό υγρό και το ιώδιο στερεό, το οποίο στην ατμόσφαιρα εξαχνώνεται. 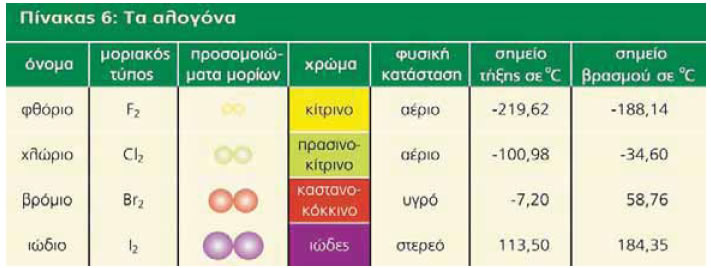
6.3 Δυσδιάλυτα άλατα αλογόνωνΠΕΙΡΑΜΑ Παρασκευάζουμε μερικά δυσδιάλυτα άλατα των αλογόνων.
|
Tα αλογόναΠαρατηρούμε:Στον πρώτο δοκιμαστικό σωλήνα σχηματίζεται ένα λευκό θόλωμα, στο δεύτερο ένα λευκοκίτρινο και στον τρίτο ένα κίτρινο θόλωμα, που οφείλεται στο σχηματισμό δυσδιάλυτων κόκκων χλωριούχου αργύρου, βρομιούχου αργύρου και ιωδιούχου αργύρου αντίστοιχα. Μετά από αρκετή ώρα οι αδιάλυτοι κόκκοι θα καταβυθιστούν στον πυθμένα των σωλήνων.
6.4 Χρήσεις των αλογόνων
|
|||||||||||||
Με λίγα λόγια
Aπαντήσεις στις ασκήσεις της ενότητας 2:
|