3. Mερικές ιδιότητες και χρήσεις των μετάλλων
Τον προϊστορικό άνθρωπο, που χρησιμοποιούσε την πέτρα ως μοναδικό υλικό για την κατασκευή εργαλείων και όπλων κατά την παλαιολιθική και νεολιθική εποχή, διαδέχθηκε ο άνθρωπος που ανακάλυψε πως η ζωή του θα γινόταν πιο εύκολη με τη χρήση των μετάλλων. Η «Eποχή του χαλκού» και η «Eποχή του σιδήρου» που ακολούθησε σήμαναν την αυγή του πολιτισμού, όπως τον ξέρουμε σήμερα. 
Έννοιες κλειδιά: απλή αντικατάσταση • δραστικότητα • κράματα • μέταλλα • οξύ • περιοδικός πίνακας Όταν θα έχετε μελετήσει την ενότητα αυτή, θα μπορείτε:
|
Mερικές ιδιότητες και χρήσεις των μετάλλων3.1 Mέταλλα και αμέταλλα
ΠΕΙΡΑΜΑ Διαπιστώνουμε μερικές ιδιότητες των μετάλλων.
Παρατηρούμε: Τα μέταλλα είναι στερεά σώματα, με εξαίρεση τον υδράργυρο που είναι υγρός. Έχουν γενικά αργυρόλευκο χρώμα (εκτός από το χρυσό που είναι κιτρινωπός και το χαλκό που έχει κόκκινη απόχρωση) και «μεταλλική» λάμψη και είναι καλοί αγωγοί της θερμότητας. Παρουσιάζουν ακόμη ένα σύνολο κοινών χαρακτηριστικών ιδιοτήτων, οι οποίες δίνονται στον Πίνακα 2. Oμοιότητα – διαφορά Στη βάση των κοινών χαρακτηριστικών ομοιοτήτων στη ζωή αλλά και στην επιστήμη συγκροτούνται ομάδες. Για παράδειγμα, οι κοινές ιδιότητες χαρακτηρίζουν μια σειρά από στοιχεία ως μέταλλα, η ιδιότητα ορισμένων ζώων να θηλάζουν τα μικρά τους τα χαρακτηρίζει ως θηλαστικά και ορισμένων φυτών να ρίχνουν τα φύλλα τους το χειμώνα τα χαρακτηρίζει ως φυλλοβόλα. Ακόμη όμως και σε οικονομικό πολιτικό επίπεδο οι χώρες με βάση κυρίως το κατά κεφαλήν εισόδημα χωρίζονται σε χώρες του αναπτυγμένου, του αναπτυσσόμενου και του τρίτου κόσμου.
Όλοι οι κανόνες έχουν τις εξαιρέσεις τους. Έτσι υπάρχουν μέταλλα με πολύ μικρές πυκνότητες, όπως το λίθιο, το νάτριο και το κάλιο, και μέταλλα με σχετικά χαμηλά σημεία τήξης και βρασμού, όπως ο υδράργυρος που είναι υγρός. |
||||||||||||||
Mερικές ιδιότητες και χρήσεις των μετάλλων3.2 Οι αντιδράσεις των μετάλλων με αραιά διαλύματα οξέωνΠΕΙΡΑΜΑ Διαπιστώνουμε τη διαφορά δραστικότητας μεταξύ μαγνησίου, αργιλίου, σιδήρου, χαλκού και υδρογόνου. 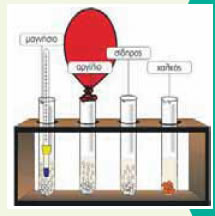 Σε τέσσερις δοκιμαστικούς σωλήνες αριθμημένους από το 1 έως το 4 που περιέχουν διάλυμα υδροχλωρίου, προσθέτουμε ρινίσματα μαγνησίου στον πρώτο, αργιλίου στο δεύτερο, σιδήρου στον τρίτο και χαλκού στον τέταρτο. Στο στόμιο του δεύτερου δοκιμαστικού σωλήνα προσαρμόζουμε ένα μπαλόνι. Σε τέσσερις δοκιμαστικούς σωλήνες αριθμημένους από το 1 έως το 4 που περιέχουν διάλυμα υδροχλωρίου, προσθέτουμε ρινίσματα μαγνησίου στον πρώτο, αργιλίου στο δεύτερο, σιδήρου στον τρίτο και χαλκού στον τέταρτο. Στο στόμιο του δεύτερου δοκιμαστικού σωλήνα προσαρμόζουμε ένα μπαλόνι.
α. Ποια σωματίδια υπάρχουν στο διάλυμα HCl; β. Τι παρατηρούμε σε κάθε δοκιμαστικό σωλήνα; γ. Είναι ίδια η ένταση του φαινομένου σε όλους τους σωλήνες;
Με αυτό τον τρόπο τα κατιόντα υδρογόνου, Η+(aq), του διαλύματος αντικαθίστανται από ιόντα Mg2+(aq), Al3+(aq) και Fe2+(aq) αντίστοιχα. Από την αντίδραση παράγονται μόρια υδρογόνου, H2(g), το οποίο φεύγει από το διάλυμα με τη μορφή φυσαλίδων και ασκώντας πιέσεις στα τοιχώματα του μπαλονιού το φουσκώνει. Ταυτόχρονα ο δοκιμαστικός σωλήνας θερμαίνεται, γιατί η αντίδραση είναι εξώθερμη. Οι ιοντικές εξισώσεις οι οποίες περιγράφουν τα φαινόμενα είναι: Mg(s) + 2H+(aq) → Mg2+(aq) + H2(g) 2Al(s) + 6H+(aq) → 2Al3+(aq) + 3H2(g) Fe(s) + 2H+(aq) → Fe2+(aq) + H2(g) Με παρόμοιο τρόπο τα μέταλλα αυτά αντιδρούν και με αραιό διάλυμα θειικού οξέος, ενώ ο χαλκός δεν αντιδρά με διάλυμα HCl ή αραιό διάλυμα H2SO4.
Συμπέρασμα: Το μαγνήσιο είναι πιο δραστικό από το αργίλιο και αυτό από το σίδηρο. Τα τρία αυτά μέταλλα είναι πιο δραστικά από το υδρογόνο. Λιγότερο δραστικός από το υδρογόνο είναι ο χαλκός ο οποίος δεν αντιδρά με τα Η+(aq). Η διάταξη των πέντε αυτών στοιχείων κατά σειρά ελαττωμένης δραστικότητας είναι: Οι προηγούμενες αντιδράσεις ονομάζονται αντιδράσεις απλής αντικατάστασης.
|
Mερικές ιδιότητες και χρήσεις των μετάλλων3.3 H απλή αντικατάστασηΑντιδράσεις απλής αντικατάστασης ονομάζονται αυτές στις οποίες ένα μέταλλο αντικαθιστά κατιόντα υδρογόνου, Η+(aq), σε ορισμένα διαλύματα οξέων ή τα ιόντα ενός άλλου μετάλλου λιγότερο δραστικού από αυτό σε διαλύματά του.
ΠΕΙΡΑΜΑ Διαπιστώνουμε τη διαφορά δραστικότητας μεταξύ σιδήρου και χαλκού.  Προσθέτουμε σε ένα ποτήρι ζέσης των 100 mL μέχρι τη μέση διάλυμα θειικού χαλκού, CuSO4, και βάζουμε ένα σιδερένιο καρφί έτσι, ώστε ένα μέρος του να εξέχει του διαλύματος. Προσθέτουμε σε ένα ποτήρι ζέσης των 100 mL μέχρι τη μέση διάλυμα θειικού χαλκού, CuSO4, και βάζουμε ένα σιδερένιο καρφί έτσι, ώστε ένα μέρος του να εξέχει του διαλύματος.
α. Τι χρώμα έχει το διάλυμα του θειικού χαλκού; β. Τι παρατηρούμε μετά από 3 περίπου λεπτά:
Οι αλλαγές αυτές οφείλονται στο γεγονός ότι τα ιόντα Cu2+(aq) αντικαθίστανται από ιόντα Fe2+(aq) σύμφωνα με την εξίσωση:
Τα άτομα χαλκού (Cu) που παράγονται επικάθονται στο σιδερένιο καρφί και το επιχαλκώνουν. Καθώς στο διάλυμα λιγοστεύουν συνεχώς τα ιόντα χαλκού και αυξάνονται τα ιόντα σιδήρου, το αρχικό μπλε χρώμα του μετατρέπεται σιγά-σιγά σε πρασινωπό, που οφείλεται στα ιόντα Fe2+(aq). Η πραγματοποίηση της αντίδρασης απλής αντικατάστασης μας οδηγεί στο συμπέρασμα ότι ο σίδηρος είναι δραστικότερο μέταλλο από το χαλκό. Έχουμε ήδη δει τη σειρά δραστικότητας πέντε στοιχείων. Με τη βοήθεια ανάλογων πειραμάτων, τα μέταλλα μαζί με το υδρογόνο διατάχτηκαν σε μια σειρά δραστικότητας, η οποία ονομάζεται ηλεκτροχημική σειρά των μετάλλων.
Κάθε μέταλλο μπορεί να αντικαταστήσει σε ένα διάλυμα με μια αντίδραση απλής αντικατάστασης:
|
Mερικές ιδιότητες και χρήσεις των μετάλλωνα. τα ιόντα των μετάλλων που είναι λιγότερο δραστικά από αυτό β. τα κατιόντα υδρογόνου σε ορισμένα διαλύματα οξέων, εφόσον το μέταλλο είναι δραστικότερο από το υδρογόνο. Έτσι, η αντίδραση Cu(s) + 2Ag+(aq) → Cu2+(aq) + 2Ag(s) πραγματοποιείται, επειδή ο χαλκός είναι πιο δραστικός από τον άργυρο, ενώ η αντίδραση Ag(s) + H+(aq) → -------- δεν πραγματοποιείται, επειδή ο άργυρος είναι λιγότερο δραστικός από το υδρογόνο.
3.4 Τα κράματαΑν ένα σιδερένιο καρφί και ένα ατσάλινο κουταλάκι μείνουν έξω στο μπαλκόνι για μερικές εβδομάδες, το καρφί θα σκουριάσει, γιατί αντιδρά με το οξυγόνο του αέρα, ενώ το κουταλάκι πρακτικά δε θα αλλοιωθεί. Αναρωτηθήκατε γιατί; Το καρφί είναι κατασκευασμένο από (περίπου) καθαρό σίδηρο, ενώ το κουταλάκι από ατσάλι, ένα μείγμα σιδήρου με άνθρακα, το οποίο είναι ένα κράμα. Aπό τη 2η χιλιετία π.X. οι άνθρωποι άρχισαν να κατασκευάζουν νέα υλικά με καλύτερες ιδιότητες, τα κράματα, με ανάμειξη και κατάλληλη επεξεργασία διαφόρων μετάλλων. Ένα από τα πρώτα κράματα που χρησιμοποίησαν είναι ο μπρούντζος, που είναι μείγμα χαλκού και κασσίτερου. Κράματα είναι τα υλικά που αποτελούνται από δύο ή περισσότερα στοιχεία, από τα οποία το ένα τουλάχιστον είναι μέταλλο, και εμφανίζουν τις ιδιότητες των μετάλλων. Σήμερα σπάνια κατασκευάζονται αντικείμενα από καθαρά μέταλλα. Με την κατάλληλη ανάμειξη δημιουργούμε υλικά με επιθυμητές ιδιότητες, όπως μεγάλη σκληρότητα, αντοχή στη διάβρωση και στη σκουριά, ιδιαίτερη μαγνητική και ηλεκτρική συμπεριφορά κτλ. Χάλυβας – Iστορικά στοιχεία O Χάλυψ είναι μυθολογικό πρόσωπο, γιος του Άρη και ιδρυτής του σκυθικού λαού των Χαλύβων, οι οποίοι κατοικούσαν στον Πόντο, και πιστεύεται ότι είναι οι πρώτοι οι οποίοι επεξεργάστηκαν το σίδηρο και δημιούργησαν «βιομηχανία». Ήταν εκπληκτικοί μεταλλουργοί και εξόρυξαν σίδηρο, άργυρο και χαλκό από τα πολυάριθμα μεταλλεία της χώρας τους, τα οποία ήταν σε λειτουργία μέχρι και τον 20ό αιώνα. Για παράδειγμα, ο ορείχαλκος, κράμα χαλκού και ψευδαργύρου, είναι πιο σκληρός τόσο από τον καθαρό χαλκό όσο και από τον καθαρό ψευδάργυρο. Ο χάλυβας (ατσάλι), κράμα σιδήρου-άνθρακα, είναι πιο σκληρός και ανθεκτικός από το σίδηρο. Συνήθως περιέχει σε μικρά ποσοστά και άλλα μέταλλα, όπως το χρώμιο που τον μετατρέπει σε ανοξείδωτο και το νικέλιο που τον καθιστά ελατό και όλκιμο. Χρησιμοποιείται, κυρίως, ως δομικό υλικό στην κατασκευή κτιρίων, γεφυρών κ.α. Στην αεροναυπηγική, αλλά και στην κατασκευή παραθυρόφυλλων χρησιμοποιούνται κράματα του αλουμινίου, τα οποία είναι ελαφριά, σκληρά και δε σκουριάζουν, αλλά είναι πολύ πιο ακριβά από το ατσάλι.
|
|||||||||||||||||||||||||
Mερικές ιδιότητες και χρήσεις των μετάλλων
Eίναι θέμα... Xημείας  Oικογένεια Aλχημιστών
Aλχημιστές: ήταν άραγε μάγοι ή επιστήμονες μιας άλλης εποχής; Η Χημεία, η επιστήμη της ύλης και των μεταβολών της, πέρασε από πολλά διαφορετικά στάδια. Η μεγαλύτερη όμως χρονική περίοδος μελέτης των ιδιοτήτων της ύλης είναι αυτή της Αλχημείας. Η λέξη Αλχημεία είναι αραβική ή ελληνοαραβική. Oρισμένοι υποστηρίζουν ότι η λέξη προέρχεται από το αραβικό άρθρο «αλ» και την ελληνική λέξη «χυμός», ενώ άλλοι από την αραβική ρίζα «Khem» (χεμ) που σημαίνει μαύρη γη, δηλαδή εύφορη γη. Στην Αλεξάνδρεια της Αιγύπτου, σημείο συνάντησης των ελληνικών, αιγυπτιακών και ανατολικών παραδόσεων, συγκεντρώθηκαν οι πρακτικές γνώσεις αιώνων και γεννήθηκε ένα σύνολο τεχνικών συνταγών με κύριο σκοπό τη μετατροπή κοινών μετάλλων σε άλλα πολύτιμα, όπως άργυρο και χρυσό. Αυτοί που ασκούσαν αυτές τις τεχνικές, οι Αλχημιστές, τις περιέβαλλαν με μυστικότητα και χρησιμοποιούσαν αλληγορική γλώσσα. Η πίστη και η εμμονή των Αλχημιστών στο στόχο τους είχε ως αφετηρία τη φιλοσοφική άποψη του Αριστοτέλη για την προέλευση της ύλης σύμφωνα με την οποία όλα τα υλικά σώματα προέρχονται από μια πρωταρχική ουσία. Oι Αλχημιστές πίστεψαν ότι είναι δυνατή η μετατροπή ενός χημικού στοιχείου σε άλλο, αρκεί να βρεθεί το κατάλληλο μέσο μεταστοιχείωσης, η φιλοσοφική λίθος. Παράλληλα, όμως, πίστευαν ότι θα εξασφάλιζαν στον άνθρωπο την αθανασία, ανακαλύπτοντας μια ουσία που θα θεράπευε όλες τις ασθένειες, το ελιξίριο της ζωής. Η Χημεία οφείλει πολλά στους Αλχημιστές. Σ’ αυτούς αποδίδεται η πρωταρχική ιδέα του χημικού συμβολισμού, η ανακάλυψη αρκετών χημικών στοιχείων, η απομόνωση και η μελέτη πολλών χημικών ενώσεων και η παρασκευή αρκετών κραμάτων. Η μεγαλύτερη, όμως, παρακαταθήκη τους στη σύγχρονη επιστήμη είναι οι εργαστηριακές τεχνικές που ανέπτυξαν, οι οποίες είναι πρόδρομες των σημερινών τεχνικών. Τι ήταν όμως τελικά οι Αλχημιστές; Μάγοι, φιλόσοφοι, πρώιμοι επιστήμονες ή παθιασμένοι κυνηγοί του πλούτου και της αθανασίας; Ασφαλώς η απάντηση δεν μπορεί να είναι μία, γιατί στη μακρόχρονη πορεία της η Αλχημεία πέρασε από πολλά και ποικίλα στάδια. Η ουτοπική επιδίωξη των Αλχημιστών να μετατρέψουν στοιχεία σε άλλα στοιχεία σήμερα μπορεί να πραγματοποιηθεί με τη διαδικασία της μεταστοιχείωσης. Η πρώτη μεταστοιχείωση πραγματοποιήθηκε από το Rutherford το 1919. Η μεταστοιχείωση, όμως, είναι πολυδάπανη μέθοδος και δε χρησιμοποιείται για την παραγωγή πολύτιμων μετάλλων.
EPΩTHΣEIΣ – AΣKHΣEIΣ
ΣΤΟΧΟΙ
2 3
3,4
3,4
3 3,4 6
|
Mερικές ιδιότητες και χρήσεις των μετάλλωνΣTHN AYΓH TOY ΠOΛITIΣMOY Η πρόοδος της ανθρωπότητας είναι κατά μεγάλο μέρος συνδεδεμένη με την ανακάλυψη και χρησιμοποίηση των μετάλλων. Από τους πρωτόγονους πολιτισμούς του λίθου και του ξύλου η ανθρωπότητα πέρασε προοδευτικά στον πολιτισμό του χαλκού, του ορείχαλκου και του σιδήρου. O σημερινός πολιτισμός θα μπορούσε να χαρακτηριστεί ως πολιτισμός του χάλυβα και των κραμάτων.
Η Εποχή του χαλκού Η Εποχή του χαλκού πρακτικά δεν αναφέρεται στη χρήση του καθαρού χαλκού, αλλά των κραμάτων του, δηλαδή του ορείχαλκου και του μπρούντζου. Στην Αίγυπτο, στην εγγύς Ανατολή και στον ελλαδικό χώρο ο χαλκός και τα κράματά του χρησιμοποιήθηκαν από τα τέλη της 4ης χιλιετίας π.Χ. και η χρήση τους συνέπεσε χρονικά με μεγάλες μεταβολές, όπως η ίδρυση των πρώτων πόλεων και δυναστειών και η εφεύρεση της γραφής. Η Εποχή του χαλκού σηματοδότησε την έναρξη της Ιστορίας. Στις αρχές της οι πολιτισμοί της Μεσοποταμίας, της Αιγύπτου, της κοιλάδας του Ινδού ποταμού, της Κίνας, ο Mινωικός και ο Mυκηναϊκός πολιτισμός γνώρισαν λαμπρή άνθηση. Για την ηπειρωτική Ευρώπη και τη δυτική Μεσόγειο η Εποχή του χαλκού διαρκεί από το 1800 π.Χ. έως το 900 π.Χ. Κατά τη διάρκειά της υπήρξε τοπική ανάπτυξη των μεταλλουργικών τεχνικών στη λεκάνη Δούναβη-Καρπαθίων και στην Ισπανία. Χαρακτηριστικό προϊόν αυτής της περιόδου είναι το «κωδωνοειδές αγγείο». Η χρήση του χαλκού σηματοδότησε σημαντικές κοινωνικές μεταβολές. Oι νομάδες κτηνοτρόφοι της προηγούμενης περιόδου εγκαταστάθηκαν μόνιμα και μεταβλήθηκαν σε φυλή πολεμιστών, η οποία επιβλήθηκε στους γεωργικούς πληθυσμούς. Oι πολέμαρχοι αυτοί ήταν οι κύριοι αγοραστές χάλκινων όπλων και κοσμημάτων. Την εποχή αυτή διαδόθηκε η χρήση της λόγχης ως πολεμικού όπλου και σε ορισμένες περιπτώσεις άρχισε η λατρεία του πέλεκη. Εφευρέθηκε η πόρπη και η κεντρική Ευρώπη επιδόθηκε στην τέχνη της σφυρηλάτησης των μετάλλων. Oι χώρες οι οποίες βρέθηκαν στον εμπορικό δρόμο του χαλκού και του κασσίτερου ωφελήθηκαν. Με το εμπόριο του χαλκού και των προϊόντων του παρατηρήθηκε διάδοση πολιτισμών και θρησκευτικών εθίμων, αλλά και μεγάλες μεταναστεύσεις λαών. Από την εκτεταμένη πολιτιστική αλληλεπίδραση και την ένταση των επαφών με την Ανατολή, η ευρωπαϊκή μεταλλουργία στα τέλη της Eποχής του χαλκού γνώρισε εξαιρετική άνθηση. Κατασκευάστηκαν νέα όπλα και εργαλεία που επέτρεψαν να αναπτυχθούν νέες μορφές καλλιέργειας, οι οποίες αποτέλεσαν τη βάση για την ανάπτυξη των πολιτισμών της Eποχής του σιδήρου.
Η Εποχή του σιδήρου Χαρακτηρίζεται από τη χρήση σιδερένιων όπλων και εργαλείων. Oυσιαστικά αρχίζει το 13ο αιώνα π.Χ. στη Μικρά Ασία, όταν ανακαλύφθηκε ότι ο σίδηρος είναι κατάλληλος για την παραγωγή στερεών και κοφτερών λεπίδων. Η τέχνη της επεξεργασίας του σιδήρου ήταν μονοπώλιο της αυτοκρατορίας των Χετταίων έως περίπου το 1270 π.Χ. που ο βασιλιάς τους δώρισε στο Φαραώ Ραμσή μ’ μερικά σιδερένια όπλα και τεχνίτες σιδηρουργούς, οπότε άρχισε η διάδοση της επεξεργασίας και χρήσης του σιδήρου και συνέπεσε με μια περίοδο ραγδαίων ανακατατάξεων στην κεντρική και ανατολική |
Mερικές ιδιότητες και χρήσεις των μετάλλων
Μεσόγειο. Oι μεγάλες αυτοκρατορίες της Αιγύπτου, των Χετταίων και των Μυκηνών κατέρρευσαν και η συσσωρευμένη ιδεολογική κληρονομιά και τεχνογνωσία αποτέλεσε το σπέρμα της δημιουργίας αυτόνομων πολιτισμών και οικονομίας στην Ελλάδα (Γεωμετρικός πολιτισμός) και στην Ιταλία (μιλλανόβιος πολιτισμός). Η χρήση του σιδήρου αποτελεί χαρακτηριστικό παράδειγμα αλληλεπίδρασης συστημάτων, τα οποία φαινομενικά δε σχετίζονται. Είχε καταιγιστική επίδραση στον τρόπο ζωής και την κοινωνική οργάνωση, όπως σχηματικά απεικονίζεται παρακάτω: Τα γεγονότα αυτά που έχουν σχέση με τον υλικό πολιτισμό απεικονίζουν τα πρώιμα στάδια
του σχηματισμού «λαών». Τα γένη ή οι φυλές οι οποίες συγκρότησαν ένα μεγάλο οικιστικό κέντρο απόκτησαν κοινά πολιτισμικά, θρησκευτικά, αισθητικά και άλλα κριτήρια, τα οποία αποτελούν προΰπόθεση για τη δημιουργία συλλογικής συνείδησης. Δραστηριότητα 1: Διαβάζοντας προσεκτικά το κείμενο και ανατρέχοντας στο βιβλίο της Iστορίας της Α’ Γυμνασίου και σε εγκυκλοπαίδειες, να καταγράψετε σε ποιους τομείς της ζωής είχε επίδραση η ανακάλυψη και χρήση του χαλκού κατά τους προϊστορικούς χρόνους. Το ίδιο να κάνετε για την ανακάλυψη και χρήση του σιδήρου. Δραστηριότητα 2: Στο κείμενο αναφέρεται: «Η χρήση του σιδήρου αποτελεί χαρακτηριστικό παράδειγμα αλληλεπίδρασης συστημάτων, τα οποία φαινομενικά δε σχετίζονται. Είχε καταιγιστική επίδραση στον τρόπο ζωής και την κοινωνική οργάνωση». Να μελετήσετε αν υπήρξαν υλικά τα οποία είχαν μεγάλη επίδραση στη ζωή των ανθρώπων κατά τον 20ό αιώνα και να περιγράψετε την επίδρασή τους.
|