 |
1. O περιοδικός πίνακαςΣε αυτό το μάθημα θα μελετήσουμε ένα από τα πιο σημαντικά «εργαλεία» της Χημείας, τον περιοδικό πίνακα. Οι άνθρωποι από τη φύση τους θέλουν να πετυχαίνουν σπουδαία αποτελέσματα καταναλώνοντας το λιγότερο δυνατό κόπο και χρόνο. Για το σκοπό αυτό προσπαθούν να ομαδοποιούν τα πράγματα με βάση κοινά κριτήρια ή κοινές ιδιότητες. Η διαδικασία αυτή ονομάζεται ταξινόμηση και διευκολύνει τη διαχείριση όλων των τομέων της ζωής.  Για παράδειγμα, η αναζήτηση στα ράφια ενός βιβλιοπωλείου είναι πιο εύκολη όταν τα βιβλία είναι ταξινομημένα κατά θέμα ή κατά συγγραφέα. Οι επιστήμονες δεν υστερούν σε οργάνωση και γι' αυτό ομαδοποιούν με κριτήριο ομοιότητες ή κοινές συμπεριφορές. Στη Φυσική οι δυνάμεις μεταξύ των σωμάτων διακρίνονται σε επαφής και από απόσταση, στη Βιολογία οι οργανισμοί διακρίνονται σε ασπόνδυλους και σπονδυλωτούς με κριτήριο το είδος του σκελετού τους. Στη Χημεία η ταξινόμηση των χημικών στοιχείων έγινε με βάση την περιοδικότητα, δηλαδή την επανάληψη των ιδιοτήτων τους με καθορισμένο τρόπο. Με την ταξινόμηση επιτυγχάνεται η μελέτη κατά ομάδες και όχι ξεχωριστά για κάθε άτομο-μέλος της ομάδας και διευκολύνεται η επικοινωνία. Έννοιες κλειδιά: αλκάλια • αλκαλικές γαίες • αλογόνα • αμέταλλα • ατομικός αριθμός • ευγενή αέρια • μέταλλα • ομάδα • περίοδος Όταν θα έχετε μελετήσει την ενότητα αυτή, θα μπορείτε:
|
O περιοδικός πίνακας1.1 Από το χθες…Γύρω στο 1860 ήταν γνωστά περίπου 60 χημικά στοιχεία και ήταν φανερό ότι υπήρχαν στοιχεία με παρόμοιες ιδιότητες. Για τους επιστήμονες ήταν πρόκληση να τα ταξινομήσουν σε ομάδες, ώστε να είναι ευκολότερη η μελέτη τους. Στη μουσική μια οκτάβα περιλαμβάνει επτά διαφορετικές νότες και μια όγδοοη που είναι ίδια με την πρώτη. Ένας από τους πρωτοπόρους στην προσπάθεια ταξινόμησης των στοιχείων ήταν ο Newlands. Ο Newlands κατέταξε τα χημικά στοιχεία από το στοιχείο με τα ελαφρύτερα άτομα προς το στοιχείο με τα βαρύτερα άτομα και παρατήρησε ότι οι ιδιότητες του όγδοου στοιχείου έμοιαζαν με τις ιδιότητες του πρώτου, του ένατου με του δεύτερου κτλ. Έτσι, το 1862 εμπνευσμένος από τη μουσική του παιδεία, διατύπωσε τον «κανόνα των οκτάβων», υποστηρίζοντας ότι μετά από μια σειρά επτά «ανόμοιων» στοιχείων ακολουθούν άλλα επτά που «επαναλαμβάνουν» τις ιδιότητες των προηγούμενων. Ο Newlands παρουσίασε τις ιδέες του το 1864 στη Χημική Εταιρεία του Λονδίνου, η οποία όμως αρνήθηκε να τις δημοσιεύσει, γιατί υπήρχαν προφανή άτοπα, όπως για παράδειγμα ότι ο σίδηρος «έπρεπε» να έχει παρόμοιες ιδιότητες με το οξυγόνο και ο φωσφόρος με το μαγγάνιο.  D. Mendeleev (1834-1907). Στο βιβλίο του «Aρχές Xημείας» συστηματοποίησε τις ιδέες του και επινόησε τον περιοδικό πίνακα ταυτόχρονα με το Γερμανό Λ. Mάγιερ Ο πρώτος περιοδικός πίνακας των στοιχείων παρουσιάστηκε λίγο πριν από το 1870 από το Ρώσο χημικό Mendeleev. Στον πίνακά του τα χημικά στοιχεία κατατάχτηκαν από το στοιχείο με τα ελαφρύτερα άτομα προς αυτό με τα βαρύτερα. Οι οριζόντιες γραμμές του πίνακα ονομάστηκαν περίοδοι και οι κατακόρυφες στήλες ονομάστηκαν ομάδες. Τα στοιχεία που είχαν παρόμοιες ιδιότητες τοποθετήθηκαν στην ίδια ομάδα. Ο Mendeleev όχι μόνο είχε την οξυδέρκεια να αφήσει στον πίνακά του κενές θέσεις για στοιχεία που δεν είχαν ακόμη ανακαλυφθεί, αλλά σε πολλές περιπτώσεις περιέγραψε ικανοποιητικά και τις ιδιότητες των στοιχείων που «έλειπαν».
1.2 Στο σήμερα: Ο σύγχρονος περιοδικός πίνακας Tα ευγενή αέρια είναι άχρωμα, άοσμα, μονοατομικά και χημικά αδρανή.
Ο σύγχρονος περιοδικός πίνακας Η 1η περίοδος περιλαμβάνει δύο στοιχεία, ενώ η 2η και η 3η περίοδος οκτώ στοιχεία η καθεμία. Η 4η και η 5η περιλαμβάνουν από 18 στοιχεία η καθεμία, ενώ η 6η περίοδος περιλαμβάνει 32 στοιχεία, εκ των οποίων τα 14 βρίσκονται σε παράρτημα εκτός του πε- |
O περιοδικός πίνακαςριοδικού πίνακα. Η 7η περίοδος δεν έχει συμπληρωθεί ακόμη. Όταν μελετώνται τα στοιχεία κατ' αύξοντα ατομικό αριθμό παρατηρείται μια σχετικά κανονική επανάληψη, δηλαδή μια περιοδικότητα, στις ιδιότητές τους. Τα στοιχεία που βρίσκονται στην ίδια ομάδα έχουν παρόμοιες χημικές ιδιότητες, ενώ οι ιδιότητες των στοιχείων που βρίσκονται σε μία περίοδο μεταβάλλονται προοδευτικά και έτσι οδηγούμαστε στο νόμο της περιοδικότητας.
Νόμος της περιοδικότητας: Οι ιδιότητες των χημικών στοιχείων είναι περιοδική συνάρτηση του ατομικού τους αριθμού. Ορισμένες ομάδες στοιχείων του πίνακα έχουν ιδιαίτερα ονόματα. Έτσι:
1.3 Τα μέταλλα και τα αμέταλλα στον περιοδικό πίνακα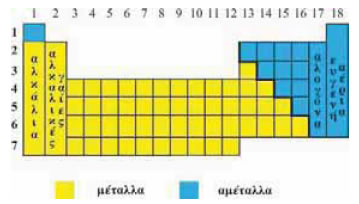 Τα χημικά στοιχεία με βάση τις ιδιότητές τους διακρίνονται επίσης σε μέταλλα και αμέταλλα. Στον περιοδικό πίνακα τα αμέταλλα καταλαμβάνουν την «επάνω δεξιά περιοχή», ενώ τα μέταλλα, που είναι πολύ περισσότερα, καταλαμβάνουν τον υπόλοιπο πίνακα.
|
O περιοδικός πίνακας1.4 Γιατί υπάρχουν χημικά στοιχεία με παρόμοιες ιδιότητες;
Τα άτομα των χημικών στοιχείων αποτελούνται από έναν πυρήνα και τα ηλεκτρόνια που κινούνται γύρω από αυτόν. Τα ηλεκτρόνια ενός ατόμου δεν έχουν όλα την ίδια ενέργεια. Όλα όσα έχουν παραπλήσια ενέργεια κινούνται στον ίδιο χώρο γύρω από τον πυρήνα και θεωρείται ότι δημιουργούν μια «στιβάδα» ηλεκτρονίων. Όσα βρίσκονται πιο κοντά στον πυρήνα, στην πρώτη στιβάδα, έχουν τη λιγότερη ενέργεια, αυτά που βρίσκονται στη δεύτερη στιβάδα έχουν περισσότερη ενέργεια, αυτά που βρίσκονται στην τρίτη ακόμα περισσότερη κτλ. Οι ιδιότητες των χημικών στοιχείων καθορίζονται από τον τρόπο που είναι κατανεμημένα τα ηλεκτρόνια στις στιβάδες. Τα στοιχεία των οποίων τα άτομα έχουν τον ίδιο αριθμό ηλεκτρονίων στην εξωτερική στιβάδα, δηλαδή στην πιο απομακρυσμένη στιβάδα από τον πυρήνα, έχουν παρόμοιες ιδιότητες. Eίναι θέμα... Xημείας Το στοιχείο 110 Το 2001 η IUPAC (International Union of Pure and Applied Chemistry), σχεδόν 6 χρόνια μετά από την πρώτη αναφορά από μια ερευνητική ομάδα με επικεφαλής τον S. Hofman στο Darmstadt της Γερμανίας, επιβεβαίωσε την ανακάλυψη του τεχνητού στοιχείου με ατομικό αριθμό 110. Το στοιχείο τοποθετήθηκε στην 7η περίοδο και 10η ομάδα του περιοδικού πίνακα. Όπως προβλέπουν οι διαδικασίες της IUPAC, τον πρώτο λόγο για το όνομα του νέου στοιχείου είχαν οι επιστήμονες οι οποίοι το ανακάλυψαν. Η ομάδα του Hofman πρότεινε το όνομα Darmstadtium (Ds) προς τιμή της περιοχής στην οποία παρασκευάστηκε. Ελάχιστα άτομα Ds έχουν παραχθεί κατά τη διάρκεια μιας πυρηνικής αντίδρασης σύντηξης πυρήνων ενός ισοτόπου του μολύβδου με ένα ισότοπο του νικελίου. Το Ds δεν υπάρχει καθόλου στο περιβάλλον και η σύντομη ζωή του δε διαρκεί περισσότερο από ένα χιλιοστό του δευτερολέπτου, μια και τα άτομα του στοιχείου διασπώνται αμέσως με εκπομπή ακτινοβολίας α. Oι επιστήμονες προβλέπουν ότι, αν απομονωθεί, θα είναι στερεό με μεταλλική λάμψη ίσως γκρίζα ή ασημένια. Πηγές: 1. Χημικά Χρονικά 12/2003, 2. www.iupac.org/newsl, 3. www.webelements.com/ Δραστηριότητα: Μπορείτε να εντοπίσετε στον περιοδικό πίνακα στοιχεία με ονόματα περιοχών, κρατών, πόλεων ή ονόματα επιστημόνων;
EPΩTHΣEIΣ – AΣKHΣEIΣ
ΣΤΟΧΟΙ
1 1 2,3
2 2
4 1
|