4. Tα άλατα Aλυκές
Μάθαμε ότι σε ένα διάλυμα υδροχλωρίου περιέχονται κατιόντα Η+ και ανιόντα Cl- και ότι σε ένα διάλυμα υδροξειδίου του νατρίου περιέχονται κατιόντα Na+ και ανιόντα ΟΗ-. Είδαμε ακόμη ότι, αν αναμειχθεί ένα διάλυμα υδροχλωρίου με την κατάλληλη ποσότητα ενός διαλύματος υδροξειδίου του νατρίου, θα πραγματοποιηθεί η αντίδραση της εξουδετέρωσης και θα προκύψει ένα ουδέτερο διάλυμα: Η+(aq) + ΟΗ-(aq) → Η2Ο(l)
Είναι φανερό ότι αυτό το ουδέτερο διάλυμα θα περιέχει τα ιόντα Cl- που περιέχονταν στο πρώτο διάλυμα και τα ιόντα Na+ που περιέχονταν στο δεύτερο. Tι θα συμβεί, άραγε, με τα ιόντα αυτά, αν εξαερωθεί το νερό του διαλύματος; 
Έννοιες κλειδιά: άλατα • ανιόντα • κατιόντα • κρύσταλλοι • ευδιάλυτα άλατα • δυσδιάλυτα άλατα Όταν θα έχετε μελετήσει την ενότητα αυτή, θα μπορείτε:
|
Tα άλατα4.1 Σχηματισμός κρυστάλλων χλωριούχου νατρίουΤι θα γίνουν, λοιπόν, τα ιόντα Na+ και τα ιόντα Cl- τα οποία περιέχονται στο διάλυμα που προκύπτει από την εξουδετέρωση ενός διαλύματος HCl με ένα διάλυμα NaOH, αν εξαερωθεί το νερό; ΠΕΙΡΑΜΑ Mε εξαέρωση παίρνουμε αλάτι. 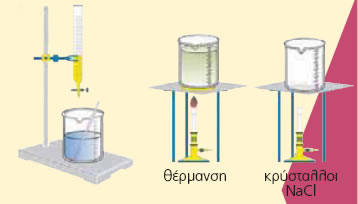
Παρατηρούμε: Aν θερμάνουμε το διάλυμα που προκύπτει από την εξουδετέρωση διαλύματος NaOH από διάλυμα HCl, έτσι ώστε να εξαερωθεί όλο τό H2O, στον πυθμένα του ποτηριού σχηματίζονται κρύσταλλοι ενός λευκού στερεού. Πρόκειται για κρυστάλλους χλωριούχου νατρίου, δηλαδή κρυστάλλους του αλατιού που τρώμε. Ο σχηματισμός του αλατιού κατά την εξαέρωση του νερού του διαλύματος μπορεί να περιγραφεί με την επόμενη χημική εξίσωση: Na+(aq) + Cl-(aq) Όταν αναμειγνύονται ένα διάλυμα υδροχλωρίου με ένα διάλυμα υδροξειδίου του νατρίου, η χημική εξίσωση που περιγράφει το φαινόμενο είναι η εξής: H+(aq) + Cl-(aq) + Na+(aq) + OH-(aq) → H2O(l) + Cl-(aq) + Na+(aq)
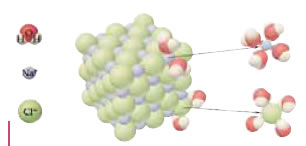 Σχηματική αναπαράσταση της διάλυσης του παραγόμενου χλωριούχου νατρίου στο νερό με τη βοήθεια προσομοιωμάτων
Τα ιόντα Na+ και Cl- που μετέχουν και στα δύο μέλη της χημικής εξίσωσης μπορούν να χαρακτηριστούν, «ιόντα-παρατηρητές». Όπως είδαμε όμως στο παραπάνω πείραμα, μπορούμε να παραλάβουμε το χλωριούχο νάτριο, αν θερμάνουμε το διάλυμα και εξαερώσουμε το νερό. |
Tα άλατα4.2 Σχηματισμός κρυστάλλων θειικού βαρίουΑς δούμε τώρα ακόμη ένα πείραμα εξουδετέρωσης. ΠΕΙΡΑΜΑ Kαταβύθιση και παραλαβή θειικού βαρίου 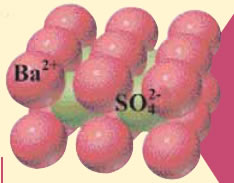
Kρυσταλλική δομή θειικού βαρίου
Παρατηρούμε: Το διάλυμα που προκύπτει από την ανάμειξη των διαλυμάτων θειικού οξέος και υδροξειδίου του βαρίου θολώνει, διότι σχηματίζονται κόκκοι ενός λευκού στερεού, οι οποίοι σιγά-σιγά καταβυθίζονται στον πυθμένα του ποτηριού. Το στερεό αυτό ονομάζεται θειικό βάριο και σχηματίζεται με τον τρόπο που περιγράφεται παρακάτω. Μπορούμε να παραλάβουμε τους κρυστάλλους του θειικού βαρίου, αν διηθήσουμε το περιεχόμενο του ποτηριού.
Το πρώτο από τα δύο διαλύματα που αναμείχθηκαν στο προηγούμενο πείραμα ήταν διάλυμα υδροξειδίου του βαρίου, επομένως περιείχε κατιόντα Ba2+ και ανιόντα ΟΗ-. Το δεύτερο ήταν διάλυμα θειικού οξέος, επομένως περιείχε κατιόντα H+ και ανιόντα SO42-. Μόλις αναμείχθηκαν τα δύο διαλύματα, συνέβησαν τα εξής: 1. Από τα ιόντα Η+ και ΟΗ- σχηματίστηκαν μόρια νερού (εξουδετέρωση).
H+(aq) + OH-(aq) → H2O(l)
2. Τα ιόντα βαρίου με τα θειικά ιόντα σχημάτισαν κρυστάλλους μιας νέας χημικής ένωσης, του θειικού βαρίου. Το θειικό βάριο πρακτικά δε διαλύεται στο νερό, οπότε οι κρύσταλλοι καταβυθίζονται στον πυθμένα του δοχείου και μπορούμε να τους παραλάβουμε με διήθηση. Ο σχηματισμός του θειικού βαρίου μπορεί να περιγραφεί με τη χημική εξίσωση:
Ba2+(aq) + SO42-(aq) → BaSO4(s)↓
4.3 Τα άλαταΌπως είδαμε, το μαγειρικό αλάτι μπορεί να παραχθεί από την αντίδραση ενός διαλύματος οξέος με ένα διάλυμα βάσης. Όλες οι ουσίες που μπορούν να παραχθούν από μια τέτοια αντίδραση και αποτελούνται από ιόντα ονομάζονται άλατα. Έτσι: Άλας ονομάζεται κάθε χημική ένωση η οποία αποτελείται από ιόντα και μπορεί να προκύψει από την αντίδραση ενός οξέος με μία βάση.
|
Tα άλατα
Από την αντίδραση λοιπόν ανάμεσα σε ένα οξύ και μια βάση παράγονται ένα άλας και νερό, όπως περιγράφεται στην εξίσωση:
Τα άλατα που προκύπτουν από την αντίδραση του θειικού οξέος με μια βάση ονομάζονται θειικά άλατα, αυτά που προκύπτουν από την αντίδραση του υδροχλωρίου με μια βάση ονομάζονται χλωριούχα άλατα και τέλος αυτά που προκύπτουν από την αντίδραση του νιτρικού οξέος με μια βάση ονομάζονται νιτρικά άλατα. Τα άλατα είναι χημικές ουσίες ιδιαίτερα διαδεδομένες στη φύση. Τα περισσότερα συστατικά του στερεού φλοιού της Γης είναι άλατα. Από άλατα είναι φτιαγμένα τα κελύφη των αυγών και των σαλιγκαριών, τα κοράλλια, οι σταλακτίτες και οι σταλαγμίτες.
1. Δε χρειάζεται οι μαθητές να αποστηθίσουν τον πίνακα. |
||||||||||||||||||||||||||||
Tα άλατα4.4 Ευδιάλυτα και δυσδιάλυτα άλατα
Yπάρχουν άλατα τα οποία διαλύονται πολύ στο νερό και τα ονομάζουμε ευδιάλυτα. Για παράδειγμα, το αλάτι (NaCl) είναι ευδιάλυτο, γιατί σε 100 g νερού θερμοκρασίας 25o C μπορούν να διαλυθούν έως 36 g αλατιού.
Yπάρχουν όμως και άλατα τα οποία διαλύονται ελάχιστα στο νερό και τα ονομάζουμε δυσδιάλυτα.
Για παράδειγμα, το θειικό ασβέστιο (CaSO4) είναι δυσδιάλυτο, γιατί σε 100 g νερού θερμοκρασίας 25o C μπορούν να διαλυθούν το πολύ 0,21 g θειικού ασβεστίου.
Eίναι θέμα... Xημείας Ένυδρα άλατα Συνήθως τα άλατα τα παραλαμβάνουμε από τα υδατικά τους διαλύματα. Αυτό συχνά έχει ως αποτέλεσμα να «εγκλωβίζονται» στους κρυστάλλους τους μόρια νερού σε ορισμένη αναλογία. Στις περιπτώσεις αυτές τα άλατα ονομάζονται ένυδρα και το νερό που περιέχεται στους κρυστάλλους τους ονομάζεται κρυσταλλικό νερό. Χαρακτηριστικά παραδείγματα ένυδρων αλάτων αποτελούν:
O συμβολισμός Na2CO3·10H2O, για παράδειγμα, δηλώνει ότι στους κρυστάλλους της σόδας σε κάθε 2 κατιόντα νατρίου αναλογούν 1 ανθρακικό ανιόν και 10 μόρια νερού.
EPΩTHΣEIΣ – AΣKHΣEIΣ
ΣΤΟΧΟΙ
3
1
2
2
2. Δε χρειάζεται οι μαθητές να αποστηθίσουν τον πίνακα. |
||||||||||||||||||||||||||||||||||
Tα άλαταAΛYKEΣ – MAΓEIPIKO AΛATI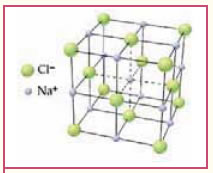
H κρυσταλλική δομή του χλωριούχου νατρίου
Το μαγειρικό αλάτι (χλωριούχο νάτριο) είναι μια χημική ένωση με χαρακτηριστική αλμυρή γεύση. Το αλάτι παραλαμβάνεται από το θαλασσινό νερό με εξάτμιση στις αλυκές και ως ορυκτό, από τα αλατωρυχεία. Yπολογίζεται ότι οι θάλασσες και οι ωκεανοί περιέχουν διαλυμένους 4.1016 τόνους χλωριούχου νατρίου. Η μεγάλη αξία του αλατιού αναγνωρίστηκε από τότε που ο άνθρωπος εγκατέλειψε τη νομαδική ζωή και η διατροφή του έπαψε να περιλαμβάνει ωμό κρέας, από το οποίο ο οργανισμός του εξασφάλιζε το αναγκαίο αλάτι (με το μαγείρεμα χάνεται ένα μεγάλο μέρος του αλατιού που περιέχει το κρέας). Στους Ρωμαίους στρατιώτες, όταν βρίσκονταν σε εκστρατεία, μοιραζόταν τακτικά αλάτι (sal) και οι μερίδες τους ονoμαζόταν salarius. Η αγγλική λέξη salary για την αμοιβή από μισθοδοσία έλκει την καταγωγή της από αυτήν την παράδοση.
 Aλυκές στην Eλλάδα
Oι αλυκές στην Ελλάδα
Στην Ελλάδα συναντάμε αλυκές πλήρως μηχανοποιημένες (Aλυκή Μεσολογγίου), αλλά και πρωτόγονες (Aλυκή Κυθήρων).
Η δημιουργία μιας αλυκής σε έναν τόπο προυποθέτει: α. την ύπαρξη μεγάλης παράκτιας και σχετικά επίπεδης έκτασης με κατάλληλο έδαφος και β. κατάλληλες μετεωρολογικές συνθήκες, που να ευνοούν την έντονη εξάτμιση και να εξασφαλίζουν χαμηλή βροχόπτωση από το Μάρτιο ως τον Oκτώβριο, που είναι η περίοδος συγκομιδής του αλατιού. Η παραγωγή μαγειρικού αλατιού από τις ελληνικές αλυκές καλύπτει το 66% περίπου των συνολικών αναγκών της χώρας μας. Το υπόλοιπο εισάγεται κυρίως από την Αίγυπτο και τη Γαλλία.
 Aλατόγουρνα Kυθήρων: μια πρωτόγονη αλυκή
Η σημασία των αλυκών ως υγροβιότοπων
Oι αλυκές δεν αποτελούν απλούς υγρότοπους. Μερικές από αυτές, όπως οι Aλυκές Μεσολογγίου, Κίτρους και Μέσης, αποτελούν υγροβιότοπους που προστατεύονται από τη διεθνή συνθήκη Ramsar. Στο σκληρό και αφιλόξενο περιβάλλον των αλυκών, οι οποίες συμπεριφέρονται σαν αλμυρές έρημοι, αντέχουν ορισμένα μόνο είδη οργανισμών.
|
Tα άλατα
 Kαστανοκέφαλος γλάρος
Oι χερσαίοι φυτικοί οργανισμοί που συναντώνται στις αλυκές ανήκουν στο γένος αλόφυτα.
Ειδικά, στην Aλυκή του Μεσολογγίου παρατηρήθηκαν εβδομήντα ένα είδη πουλιών, που έκαναν μόνιμη ή περιστασιακή χρήση των χώρων της αλυκής, από τα οποία είκοσι πέντε χαρακτηρίζονται ως είδη απειλούμενα με εξαφάνιση σε ευρωπαϊκό επίπεδο και είκοσι προστατεύονται από ελληνικές, κοινοτικές ή διεθνείς συμβάσεις.
Χρήσεις του χλωριούχου νατρίου Χρησιμοποιείται για την άρτυση των τροφών, καθώς επίσης για τη διατήρηση και τη συντήρηση τροφίμων (παστό κρέας, παστά ψάρια, τουρσιά κτλ.). Επίσης, χρησιμοποιείται στη βιομηχανία, για την τήξη των πάγων στους δρόμους και για την παρασκευή φυσιολογικού ορού, ο οποίος είναι υδατικό διάλυμα χλωριούχου νατρίου που είναι ισοτονικό με το αίμα. Η ετήσια παγκόσμια κατανάλωση χλωριούχου νατρίου είναι περίπου 150 εκατομμύρια τόνοι. Το ποσοστό από την ποσότητα αυτή το οποίο χρησιμοποιείται για τη διατροφή είναι μικρό, όπως φαίνεται στο παρακάτω διάγραμμα.
Δραστηριότητα 1: Να καταγράψετε τις κυριότερες αλυκές στον ελλαδικό χώρο, αναφέροντας την έκτασή τους, καθώς και τη δυναμικότητά τους στην παραγωγή αλατιού.
Δραστηριότητα 2: Για πολλά χρόνια το αλάτι είχε πολύ υψηλή φορολογία. Να βρείτε στοιχεία για το καθεστώς φορολόγησης του αλατιού στην Ελλάδα από την ίδρυση του ελληνικού κράτους μέχρι σήμερα και να αναζητήσετε τους λόγους που οδήγησαν στη φορολόγησή του.
www.saltworks.gr |
Tα άλαταH ΣOΔA KAI OI AΠAPXEΣ THΣ XHMIKHΣ BIOMHXANIAΣΚατά τον 18ο αιώνα η σόδα πλυσίματος (ανθρακικό νάτριο, Na2CO3) ήταν απαραίτητη για τη λειτουργία των σαπωνοποιείων, των υαλουργείων, των βαφείων και των χαρτοβιομηχανιών. Παραγόταν κυρίως με καύση φυκιών, οι στάχτες των οποίων περιείχαν 20-33% ανθρακικό νάτριο. Το 1775 η Bασιλική Ακαδημία Επιστημών της Γαλλίας προκήρυξε διαγωνισμό για την επινόηση μεθόδου παρασκευής φτηνής σόδας με πρώτη ύλη το χλωριούχο νάτριο (NaCl). Το 1789 παραμονές της Γαλλικής Επανάστασης, το διαγωνισμό κέρδισε ο Leblanc (1742-1806), γιατρός και ερασιτέχνης χημικός, ο οποίος, σύμφωνα με πολλούς βιογράφους του, δεν έλαβε ποτέ τα χρήματα του βραβείου. Η παρασκευή σόδας με τη μέθοδο Leblanc αποτέλεσε ένα από τα κύρια θεμέλια της χημικής βιομηχανίας. Ως πρώτες ύλες εκτός από το χλωριούχο νάτριο χρησιμοποιήθηκαν θειικό οξύ, άνθρακας και ασβεστόλιθοι (CaCO3). Αυτό είχε ως συνέπεια γύρω από κάθε εργοστάσιο παρασκευής σόδας να «χτίζεται» ένα ολόκληρο σύστημα και άλλων βιομηχανιών, όπως βιομηχανιών παρασκευής θειικού οξέος. Τη βιομηχανική ανάπτυξη όμως την ώθησαν και τα «μειονεκτήματα» της μεθόδου: το κύριο παραπροϊόν αυτής της παρασκευής ήταν το αέριο υδροχλώριο (HCl), το οποίο δημιουργούσε περιβαλλοντικά προβλήματα. Το 1863 λοιπόν η αγγλική κυβέρνηση θέσπισε νόμο που υποχρέωνε τις βιομηχανίες να βρουν τρόπους αξιοποίησης του υδροχλωρίου. Αυτό είχε ως συνέπεια την ανάπτυξη και νέων χημικών βιομηχανιών, οι οποίες χρησιμοποιούσαν το υδροχλώριο για την παρασκευή λευκαντικών απαραίτητων για την κλωστοϋφαντουργία. Η μέθοδος Leblanc για την παρασκευή σόδας άρχισε να εκτοπίζεται μετά το 1865 από μια νέα μέθοδο, τη μέθοδο του Bέλγου εφευρέτη Ernest Solvay, η οποία ήταν οικονομικότερη και παρήγαγε καθαρότερο προϊόν. Σήμερα η σόδα παράγεται από ορυκτά που περιέχουν μεταξύ άλλων αλάτων ανθρακικό νάτριο.
Αλληλεπίδραση – Μεταβολή
Με το παράδειγμα της ανάπτυξης της χημικής βιομηχανίας του 18ου αιώνα βλέπουμε πως η μεταβολή σε ένα σύστημα, την επιστήμη της Χημείας, επέδρασε και μετέβαλε σημαντικά τα δεδομένα ευρύτερων συστημάτων με έμμεσο αλλά καθοριστικό τρόπο.
|