3. EξουδετέρωσηΣτο παρακάτω σκίτσο η μαμά αναρωτιέται αν την κόρη της την τσίμπησε σφήκα ή μέλισσα, για να διαλέξει αν θα φέρει ξίδι ή αμμωνία. Το δηλητήριο της σφήκας περιέχει βάση, ενώ αυτό της μέλισσας περιέχει οξύ. Γιατί το ξίδι και η αμμωνία μας βοηθούν να αντιμετωπίζουμε τα τσιμπήματα; 
Έννοιες κλειδιά: εξουδετέρωση •μπλε της βρωμοθυμόλης Όταν θα έχετε μελετήσει την ενότητα αυτή, θα μπορείτε:
|
Eξουδετέρωση3.1 EξουδετέρωσηΠΕΙΡΑΜΑ Mία τρίχρωμη σημαία 
Το μπλε της βρωμοθυμόλης είναι ένας δείκτης ο οποίος, αν προστεθεί:
ΠΕΙΡΑΜΑ Παρασκευή ουδέτερου διαλύματος 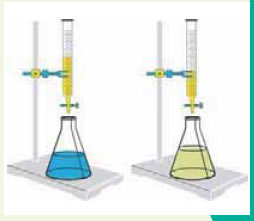
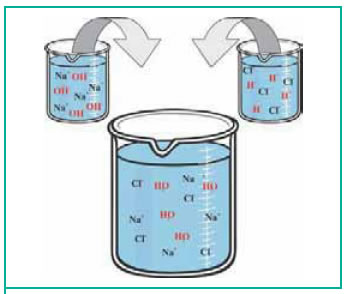 Kατά την ανάμειξη διαλύματος NaOH με διάλυμα HCl τα H+ και τα OH- εξουδετερώνονται. Τι συνέβη; Πού πήγαν τα ιόντα που έδιναν τις βασικές ιδιότητες στο πρώτο διάλυμα και τις όξινες ιδιότητες στο δεύτερο;
Όταν αναμειγνύουμε ένα διάλυμα οξέος με ένα διάλυμα βάσης, τα ιόντα Η+ και τα ιόντα ΟΗ- συνδέονται μεταξύ τους σχηματίζοντας μόρια νερού: Η+ (aq) + ΟΗ- (aq) → H2O(l)
Η αντίδραση αυτή ονομάζεται εξουδετέρωση, ακριβώς διότι «εξουδετερώνονται», «εξαφανίζονται», τόσο οι ιδιότητες του οξέος όσο και αυτές της βάσης. |
EξουδετέρωσηOι ιδιότητες των οξέων και των βάσεων βρίσκονται σε στενή σχέση με τη δομή τους, ακριβώς όπως οι συμπεριφορές των φίλων σας σχετίζονται με τη δομή της προσωπικότητάς τους. Στις παρέες, η επικοινωνία μεταξύ ανθρώπων με διαφορές στους χαρακτήρες και η αλληλεπίδρασή τους μπορεί να οδηγήσει σε μεταβολές στη συμπεριφορά όλων. Στην περίπτωση που ένα οξύ και μια βάση θα βρεθούν στο ίδιο υδατικό διάλυμα, η αλληλεπίδραση είναι πιθανόν να οδηγήσει σε μια μεγάλη μεταβολή: στο να «εξουδετερωθεί» τόσο ο όξινος όσο και ο βασικός χαρακτήρας.
Στο σημείο αυτό προκύπτει το ερώτημα: Όταν αναμειγνύουμε ένα διάλυμα οξέος με ένα διάλυμα βάσης προκύπτει πάντοτε ουδέτερο διάλυμα;
Αν αναμείξουμε τυχαίες ποσότητες των δύο διαλυμάτων, το τελικό διάλυμα μπορεί να είναι όξινο ή βασικό ή ουδέτερο.
Πότε θα είναι όξινο και πότε βασικό;
Eίναι θέμα... Xημείας Αντιόξινα
Τσιμπήματα εντόμων
Oι μέλισσες και οι σφήκες, για να προστατευτούν από τους εχθρούς τους, φέρουν στο κάτω μέρος της κοιλιάς τους το κεντρί, ένα σωλήνα που επικοινωνεί με ειδικούς αδένες. Το δηλητήριο που εκκρίνουν οι αδένες της μέλισσας περιέχει οξύ, ενώ της σφήκας περιέχει βάση. Τα τσιμπήματά τους μας προκαλούν πόνο. Για να τον «εξουδετερώσουμε», στην περίπτωση που μας τσιμπήσει μέλισσα χρησιμοποιούμε αμμωνία, δηλαδή ένα διάλυμα βάσης, ενώ στην περίπτωση που μας τσιμπήσει σφήκα χρησιμοποιούμε ξίδι, δηλαδή ένα διάλυμα οξέος.
Το pH του εδάφουςTo pH είναι μια πολύ σημαντική ιδιότητα του εδάφους, διότι επηρεάζει τη γονιμότητά του και καθορίζει το είδος των φυτών που μπορούμε να καλλιεργήσουμε. Τα εδάφη που περιέχουν ορυκτά του αργιλίου ή του πυριτίου είναι όξινα, ενώ τα εδάφη που περιέχουν ορυκτά του ασβεστίου είναι βασικά. Σε εδάφη με pH μεταξύ του 5 και του 6,5 μπορούμε να καλλιεργήσουμε σιτάρι, αμπέλια και φράουλες. Σε βασικά εδάφη μπορούμε να καλλιεργήσουμε τεύτλα.
|
EξουδετέρωσηEPΩTHΣEIΣ – AΣKHΣEIΣ
ΣΤΟΧΟΙ
2
1,2
2
1
α. Με ασπιρίνη, στην οποία η δραστική ουσία είναι κάποιο οξύ β. Με δισκία αντιόξινου φαρμάκου, στα οποία οι δραστικές ουσίες είναι κυρίως το υδροξείδιο του αργιλίου, Al(OH)3, και το υδροξείδιο του μαγνησίου, Mg(OH)2.
|