 |
1. Tα οξέα
Στις ετικέτες των μπουκαλιών της διπλανής φωτογραφίας, στις οποίες αναγράφεται η σύσταση του περιεχομένου τους, υπάρχει μια κοινή λέξη, η λέξη οξύ.

Έννοιες κλειδιά: oξύ • όξινος χαρακτήρας • δείκτες • κατιόν υδρογόνου •κλίμακα pH • οξύτηταΌταν θα έχετε μελετήσει την ενότητα αυτή, θα μπορείτε:
|
Tα οξέα1.1 Ιδιότητες των οξέωνΤα υδατικά διαλύματα των οξέων έχουν ορισμένες κοινές ιδιότητες. Μερικές από αυτές γίνονται αντιληπτές με το πείραμα που ακολουθεί. ΠΕΙΡΑΜΑ Διαπιστώνουμε μερικές από τις ιδιότητες των οξέων. Στύβουμε ένα λεμόνι.
Και λίγη ιστορία... Στο «Μάθημα Χημείας», που δημοσίευσε το 1675 ο N. Lemery, για να εξηγήσει γιατί ένα υγρό είναι όξινο, διατυπώνει την παρακάτω άποψη: «Τα όξινα υγρά περιέχουν αιχμηρά σωματίδια, τα οποία προκαλούν τσούξιμο στη γλώσσα. Όσο πιο λεπτές είναι οι αιχμές αυτών των σωματιδίων, τόσο μεγαλύτερη είναι και η δυνατότητά τους να εισέρχονται στους πόρους των σωμάτων με τα οποία έρχονται σε επαφή.» Όπως φαίνεται από το κείμενο, ο Lemery, ως χημικός του 17ου αιώνα, χτίζει λανθασμένα την άποψη για τα οξέα με πρωταγωνιστές τα σχήματα και την κίνηση. Οι ιδιότητες που παρατηρήσαμε στο προηγούμενο πείραμα είναι χαρακτηριστικές των διαλυμάτων των οξέων και όχι μόνο του κιτρικού οξέος που περιέχεται στο χυμό του λεμονιού ή του αραιού υδροχλωρικού οξέος. Ας τις εξετάσουμε πιο αναλυτικά: 1. Τα διαλύματα των οξέων έχουν όξινη γεύση.Η χαρακτηριστική όξινη (ξινή) γεύση των οξέων γίνεται αντιληπτή, όταν πίνουμε ένα φυσικό χυμό πορτοκαλιού ή λεμονιού, τα οποία περιέχουν κιτρικό οξύ, όταν τρώμε τη σαλάτα μας με ξίδι το οποίο περιέχει οξικό οξύ ή όταν τρώμε γιαούρτι το οποίο περιέχει γαλακτικό οξύ.  Προσοχή: Απαγορεύεται να δοκιμάζουμε τη γεύση οξέων που υπάρχουν στο εργαστήριο, όπως νιτρικό οξύ, θειικό οξύ και υδροχλωρικό οξύ. Κινδυνεύουμε να πάθουμε σοβαρά εγκαύματα. Προσοχή: Απαγορεύεται να δοκιμάζουμε τη γεύση οξέων που υπάρχουν στο εργαστήριο, όπως νιτρικό οξύ, θειικό οξύ και υδροχλωρικό οξύ. Κινδυνεύουμε να πάθουμε σοβαρά εγκαύματα.
2. Τα διαλύματα των οξέων μεταβάλλουν το χρώμα των δεικτών. Διαλύματα οξέων με δείκτη «κόκκινο» λάχανο
Οι δείκτες είναι χημικές ουσίες οι οποίες με την παρουσία οξέων αλλάζουν χρώμα. Για παράδειγμα, αν προσθέσουμε λίγες σταγόνες του δείκτη μπλε της βρωμοθυμόλης στο διάλυμα οποιουδήποτε οξέος, το διάλυμα θα πάρει κίτρινο χρώμα. Οι πιο συνηθισμένοι από τους δείκτες που χρησιμοποιούνται στα χημικά εργαστήρια είναι το βάμμα του ηλιοτροπίου, η ηλιανθίνη, το μπλε της βρωμοθυμόλης και η φαινολοφθαλεΐνη. Δείκτες περιέχονται στο κόκκινο λάχανο, στο τσάι, στα πέταλα πολλών λουλουδιών, όπως τα κόκκινα τριαντάφυλλα, τα γεράνια, οι πετούνιες, στα «ιταλικά» ραδίκια και αλλού. |
Tα οξέα Eπίδραση διαλύματος
υδροχλωρίου σε κομματάκια μαρμάρου 3. Τα διαλύματα των οξέων αντιδρούν με το μάρμαρο και τη μαγειρική σόδα. Από τις αντιδράσεις αυτές παράγεται διοξείδιο του άνθρακα.Αν ρίξουμε ξίδι πάνω σε μαγειρική σόδα ή σε μικρά κομμάτια μαρμάρου, θα παρατηρήσουμε σχηματισμό φυσαλίδων. Το οξικό οξύ που περιέχεται στο ξίδι αντιδρά με τη σόδα. Από τη χημική αντίδραση παράγεται ένα αέριο σε μορφή φυσαλίδων, το διοξείδιο του άνθρακα. Παρόμοια φαινόμενα θα παρατηρήσουμε αν αντί για ξίδι χρησιμοποιήσουμε χυμό λεμονιού. Στις δύο προηγούμενες περιπτώσεις πραγματοποιούνται οι χημικές αντιδράσεις: οξύ + μάρμαρο → ..... + διοξείδιο του άνθρακα ↑ οξύ + μαγειρική σόδα → ..... + διοξείδιο του άνθρακα ↑ Τόσο η μαγειρική σόδα όσο και το μάρμαρο ανήκουν σε μια κατηγορία χημικών ενώσεων που ονομάζονται ανθρακικά άλατα (για τα άλατα θα μιλήσουμε σε επόμενη ενότητα). Τα διαλύματα των οξέων, κατά κανόνα, αντιδρούν με τα ανθρακικά άλατα. οξύ + ανθρακικό άλας → ..... + διοξείδιο του άνθρακα ↑ 4. Τα διαλύματα των οξέων αντιδρούν με πολλά μέταλλα και ελευθερώνουν αέριο υδρογόνο.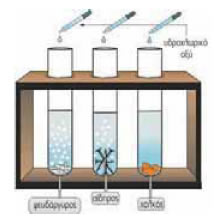 Eπίδραση διαλύματος υδροχλωρίου σε ορισμένα μέταλλα Αν βάλουμε σε ένα δοκιμαστικό σωλήνα μικρά κομμάτια ψευδαργύρου και ρίξουμε μέσα διάλυμα υδροχλωρίου, θα παρατηρήσουμε παραγωγή ενός αερίου. Το αέριο αυτό είναι το υδρογόνο. Όπως ο ψευδάργυρος, έτσι και πολλά άλλα μέταλλα αντιδρούν με ορισμένα διαλύματα οξέων και παράγουν αέριο υδρογόνο. οξύ + μέταλλο → ..... + υδρογόνο ↑ Μερικά μέταλλα, όπως ο χαλκός, δεν αντιδρούν με αυτά τα διαλύματα. Το σύνολο των κοινών ιδιοτήτων των διαλυμάτων των οξέων ονομάζεται όξινος χαρακτήρας.Όξινος χαρακτήρας
Τα υδατικά διαλύματα των οξέων:
|
Tα οξέα1.3 H κλίμακα pH (πε-χα) ως μέτρο της οξύτητας
|
Tα οξέα To χρώμα του δείκτη μπλε
της βρωμοθυμόλης σε όξινο και ουδέτερο περιβάλλον αντίστοιχα Από την ίδια χημική εξίσωση προκύπτει επίσης ότι τα κατιόντα υδρογόνου που παράγονται από τα μόρια του νερού είναι ίσα με τα ανιόντα υδροξειδίου. Έτσι, στο καθαρό νερό (δηλαδή στο νερό που δεν περιέχει καμία διαλυμένη ουσία) ισχύει: πλήθος Η+(aq) = πλήθος ΟΗ-(aq) (1) Η περιεκτικότητα ενός διαλύματος σε κατιόντα υδρογόνου εκφράζεται όμως με έναν αριθμό, το pH του διαλύματος. Εφόσον και στο καθαρό νερό περιέχονται κατιόντα υδρογόνου, συμπεραίνουμε ότι και στο καθαρό νερό αντιστοιχεί κάποια τιμή pH:
Το pH του καθαρού νερού είναι 7 (στους 25o C).
Το ίδιο pH με το καθαρό νερό (pH = 7) έχουν και όλα τα υδατικά διαλύματα στα οποία ισχύει η σχέση (1) στους 25o C. Τα διαλύματα αυτά ονομάζονται ουδέτερα.
1.5 Το pH των όξινων διαλυμάτωνΌπως είδαμε, όταν ένα οξύ διαλύεται στο νερό, παρέχει κατιόντα υδρογόνου. Επομένως, στα διαλύματα των οξέων τα ιόντα Η+ θα είναι περισσότερα από τα ιόντα ΟΗ-. Έτσι:
σε κάθε διάλυμα οξέος ισχύει: πλήθος Η+(aq) > πλήθος ΟΗ-(aq)
Η πρόταση αυτή είναι ισοδύναμη με την πρόταση που έχουμε αναφέρει στην §1.3:
σε κάθε διάλυμα οξέος ισχύει: pH < 7
Επισημάνσεις
1.6 Μέτρηση του pH ενός διαλύματος Mέτρηση του pH με τη βοήθεια
πεχάμετρου Το pH ενός διαλύματος μπορούμε να το μετρήσουμε με πεχάμετρο ή με πεχαμετρικό χαρτί. Το πεχάμετρο είναι ένα ηλεκτρονικό όργανο το οποίο χρησιμοποιείται για την ακριβή μέτρηση του pH ενός διαλύματος. Το πεχαμετρικό χαρτί είναι ένα ειδικό απορροφητικό χαρτί εμποτισμένο με μείγμα δεικτών (δείκτης Universal ή γενικός δείκτης), το οποίο αλλάζει χρώμα ανάλογα με το pH του διαλύματος. Μας επιτρέπει να βρίσκουμε πολύ εύκολα το pH του διαλύματος, αλλά όχι με μεγάλη ακρίβεια.
|
Tα οξέαΠΕΙΡΑΜΑ Mετράμε το pH ενός διαλύματος. 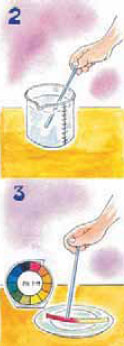 
Eίναι θέμα... Xημείας Μέλισσες και οξέα Το δηλητήριο της μέλισσας περιέχει ένα οξύ, στο οποίο οφείλεται ο ενοχλητικός ερεθισμός που προκαλεί. Oι βασίλισσες εκκρίνουν επίσης μια «βασιλική» ουσία, ένα οξύ, που έλκει τους κηφήνες για το ζευγάρωμα. Πικραμύγδαλα για εκτελέσεις; Το υδροκυάνιο είναι ένα οξύ, το οποίο είναι ισχυρότατο δηλητήριο, καθώς δόση 0,05 g είναι θανατηφόρα για τον άνθρωπο. Στα πικραμύγδαλα περιέχεται μια χημική ουσία, η αμυγδαλίνη, από τη διάσπαση της οποίας παράγεται υδροκυάνιο (σε αυτό οφείλεται η χαρακτηριστική οσμή τους). Φυσικά η ποσότητά του είναι τόσο μικρή, που κανείς δε θα μπορούσε να χρησιμοποιήσει πικραμύγδαλα ως φονικό όπλο. Στο ζωικό βασίλειο ένα είδος σαρανταποδαρούσας εξοντώνει τους εχθρούς του, εκκρίνοντας μια χημική ουσία η οποία διασπάται ακαριαία και ελευθερώνει υδροκυάνιο.
EPΩTHΣEIΣ – AΣKHΣEIΣ
ΣΤΟΧΟΙ
6 6 1,6 6 1,2,6
1,3,6
|
Tα οξέαH IΣTOPIA ENOΣ YΠEPAIΩNOBIOY ΦAPMAKOY Tα αποστάγματα από τα φύλλα της ιτιάς
έχουν φαρμακευτικές ιδιότητες γνωστές από την αρχαιότητα.  Tο κτίριο της Bayer ντυμένο με τη μακέτα
του κουτιού της ασπιρίνης για τον εορτασμό των 100 χρόνων της. Γύρω στο 400 π.Χ. ο Ιπποκράτης συνιστούσε αφέψημα από φύλλα ιτιάς, για να καταπραΰνει τον πόνο της γέννας. Το 1763 ο αιδεσιμότατος Ε. Stone, ο οποίος αναζητούσε νέα φάρμακα, έμαθε ότι οι χωρικοί της ενορίας του χρησιμοποιούσαν αφέψημα από φλούδα ιτιάς ως αντιπυρετικό. Ήταν φανερό λοιπόν ότι κάποια ουσία στα φύλλα και το φλοιό του δέντρου είχε φαρμακευτικές ιδιότητες. Όταν οι χημικοί, πολύ αργότερα, απομόνωσαν το δραστικό συστατικό του φλοιού, διαπίστωσαν ότι ήταν ένα οξύ που ονομάστηκε σαλικυλικό οξύ από το λατινικό νομα του δέντρου (Salix). Το 1897 ο Γερμανός χημικός F. Hoffmann πέτυχε την εργαστηριακή σύνθεση του σαλικυλικού οξέος και η ευρεσιτεχνία του κατοχυρώθηκε από τη χημική εταιρεία Bayer. Ένα χρόνο αργότερα παρασκεύασε ένα παράγωγο του σαλικυλικού οξέος, εξίσου δραστικό, αλλά με λιγότερες παρενέργειες. Το παράγωγο αυτό, το ακετυλοσαλικυλικό οξύ, είναι το δραστικό συστατικό της γνωστής σε όλους ασπιρίνης. Την ίδια χρονιά η Bayer έβγαλε στην αγορά την ασπιρίνη και μέχρι τον Α' Παγκόσμιο πόλεμο προστάτεψε την πατέντα παρασκευής της και το εμπορικό της όνομα με διεθνείς συμφωνίες. Με την ήττα όμως της Γερμανίας χάθηκαν και πολλά δικαιώματα γερμανικών εταιρειών. Έτσι, παρασκευάστηκαν και άλλα φάρμακα με δραστικό συστατικό το ακετυλοσαλικυλικό οξύ, χωρίς όμως να κλονιστεί τελικά η κυριαρχία της ασπιρίνης στην αγορά. Η αναλγητική, αντιπυρετική και προληπτική έναντι των καρδιακών παθήσεων δράση της ασπιρίνης είναι τόσο αποτελεσματική, ώστε παραμένει πολύ δημοφιλές φάρμακο. Είναι το φάρμακο με τη μεγαλύτερη διάρκεια ζωής και τη μεγαλύτερη κατανάλωση σε ολόκληρο τον κόσμο. Oι ταμπλέτες ασπιρίνης που παράγονται σε ένα χρόνο μπορούν να φτιάξουν ένα μονοπάτι που πάει στο φεγγάρι και επιστρέφει!!! Δραστηριότητα 1: Να διερευνήσετε αν, εκτός από την ασπιρίνη, υπάρχουν και άλλα φάρμακα τα οποία έλκουν την καταγωγή τους από βότανα ή φυτά και των οποίων η φαρμακευτική δράση ήταν γνωστή από τα παλιά χρόνια. Μπορείτε να:
Δραστηριότητα 2: Oι φαρμακευτικές εταιρείες καθορίζουν τις τιμές των φαρμάκων χωρίς να λαμβάνουν υπόψη τους το φτωχό τρίτο κόσμο. Με δεδομένο ότι οι εταιρείες αυτές έχουν την αποκλειστικότητα της διάθεσης των φαρμάκων αυτών, τα τελευταία χρόνια έχει ξεκινήσει μια κριτική σε διεθνές επίπεδο. Να συγκεντρώσετε στοιχεία γι' αυτό το θέμα και να διατυπώσετε τη δική σας άποψη, τεκμηριώνοντάς την με στοιχεία τόσο ανθρωπιστικού όσο και οικονομικού χαρακτήρα. |